El floema está involucrado en el transporte de nutrientes producto de la fijación del carbono de las hojas fotosintéticas a los tejidos heterotróficos, mediante un conjunto de haces vasculares que interconecta las diferertes partes de las plantas. Trabajos clásicos y evidencias más recientes sugieren que el floema distribuye señales que regulan diversos procesos en plantas, desde la inducción de la floración hasta la respuesta a patógenos. En este trabajo se describe el papel del floema como conducto por el que trasiegan y pueden ser amplificadas señales que, de manera global, influyen en la homeostasis y desarrollo de plantas.
Los organismos multicelulares requieren que sus diferentes tipos celulares o tejidos verdaderos coordinen su crecimiento y desarrollo de manera eficiente. Así, en el caso de plantas, los tejidos u órganos fotosintéticos producen los nutrientes que requieren tejidos no fotosintéticos para su crecimiento, siendo transportados por conductos especializados que conforman el tejido vascular. Este a su vez está formado por xilema, el conjunto de vasos que transportan agua y nutrientes minerales de la raíz al resto de la planta, y el floema, que transporta el carbono fijado en las hojas maduras a los tejidos heterotróficos. Sin embargo, el tejido vascular, y en particular el floema, no sólo están involucrados en el transporte de nutrientes. Por ejemplo, tejidos apicales no expuestos a la luz son capaces de responder a la luz, como en el caso de la inducción floral, merced al transporte de señales emitidas por las hojas fotosintéticamente activas que han percibido inicialmente el estímulo a través del floema (1). Cabe mencionar que la maquinaria requerida para responder a dicho estímulo probablemente no está presente en el ápice (clorofila, por ejemplo, aunque existen cloroplastos inmaduros; 1). El papel del floema no se limita al de conducto pasivo; evidencias obtenidas recientemente apuntan a un papel activo no sólo en el transporte de señales, sino en el relevo y generación de las mismas. Como se detallará a continuación, diversos procesos en plantas requieren la señalización a través del floema y, por extensión, comunicación entre tejidos y/u órganos distantes. En resumen, la imagen que emerge del floema es la de un tejido dinámico, que juega un papel clave en el desarrollo y homeostasis de plantas vasculares.
El surgimiento de un sistema vascular en plantas, probablemente al inicio del periodo devónico, seguramente jugó un papel importante en su diversificación y colonización de nuevos nichos, permitiendo un transporte más rápido y eficiente de nutrientes (y señales regulatorias, como se discutirá a continuación) a toda la planta. La función primaria de la red de haces vasculares, el xilema y el floema, es el transporte de nutrientes minerales y agua de la raíz al resto de la planta, y de nutrientes producto de la fotosíntesis de las hojas maduras a tejidos heterotróficos (no fotosintéticos; figura 1). La función del floema se conoce desde hace tiempo por los trabajos pioneros de, entre otros, Münch y Esau (a quien bien se le podría considerar la Ramón y Cajal de la fisiología vegetal; 2). El xilema se compone de tubos que derivan de células que durante su desarrollo sufren un proceso análogo al de la muerte celular programada, dando como resultado vasos con pared reforzada, carentes de membrana plasmática y, aparentemente, cualquier otra estructura característica de células vivas; estos transportan agua y nutrientes minerales absorbidos en las raíces al resto de la planta. En contraste, el floema funcional consta de dos tipos celulares vivos, la célula aneja y el elemento criboso. En su madurez, los canales citoplásmicos que interconectan a la práctica totalidad de las células vegetales se modifican en elementos cribosos vecinos, generando estructuras de baja resistencia (las placas cribosas). El conjunto de elementos cribosos maduros anticlinales constituye la red de vasos por los que se transportan los productos de la fotosíntesis de hojas maduras al resto de la planta. Como se muestra en la figura 2, los elementos cribosos maduros carecen de núcleo y, probablemente, ribosomas funcionales, si bien parecen contener orgánulos como plástidos y mitocondrias. Sin embargo, a diferencia del xilema, los elementos cribosos conservan una membrana plasmática funcional, que juega un papel destacado tanto en el transporte al interior del floema de nutrientes, como de su descarga en tejidos consumidores (no fotosintéticos). Los elementos cribosos están interconectados con las células anejas por medio de plasmodesmos especializados con un límite de exclusión considerablemente mayor al que se observa en otros tejidos. Aparte de la distinción obvia entre xilema y floema (la muerte celular programada sólo está involucrada en la maduración del primero), las fuerzas que gobiernan el transporte de solutos en ambos tejidos son capilaridad en el caso del xilema, y ósmosis y flujo de masas en el segundo en respuesta a un gradiente de concentración de solutos. De esta forma, el floema es un tejido fundamentalmente cerrado comparado con el xilema, la fuerza de cuyo flujo está determinada a su vez por la capacidad fotosintética de la planta y por el vigor de los tejidos consumidores. Es decir, los productos de la fotosíntesis, principalmente sacarosa, son continuamente retirados del floema a través de plasmodesmos y de transportadores transmembranales hacia las células vecinas o al espacio intercelular en los tejidos consumidores, lo que crea un efecto sifón con respecto al tejido fotosintético. Cabe mencionar que no se conocen con precisión los mecanismos que regulan y concilian las demandas energéticas de los diferentes tejidos consumidores, pero probablemente dependen de señales transportadas a través de los plasmodesmos. Es decir, el fenómeno denominado “reparto por floema” (phloem partitioning) de los fotosintatos no es sólo una propiedad contingente de este tejido, sino una función regulada por el intercambio de señales entre los tejidos consumidores y fuente (3). La capacidad de las proteínas de movimiento viral de alterar el reparto por floema de sacarosa, así como la proporción de la parte aérea de la planta con respecto a la raíz, apoya esta noción (4).
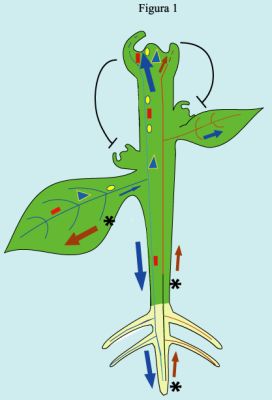 |
Figura 1. Esquema que representa el transporte de moléculas señalizadoras por el floema (azul) y xilema (rojo). La fuerza de flujo de ambos conductos está representada por el tamaño relativo de las flechas roja (xilema) y azul (floema). Para el xilema la fuerza es mayor en las hojas maduras cuya transpiración es mayor, mientras que es en tejidos jóvenes o no fotosintéticos en los que la fuerza de flujo del floema es mayor. En la inducción floral, un estímulo (un umbral de luz rebasado, por ejemplo) estimula la producción o liberación de una señal o conjunto de señales que se trasloca del mesófilo hasta el floema, en donde activa al gen CONSTANS. Este a su vez induce la producción de una señal (triángulo azul) que se desplaza a través del floema hasta el ápice, induciendo propiamente la floración. La sequía induce la generación de otra señal, el ácido abscísico (asterisco negro), que es transportado a través del xilema a hojas maduras. En éstas se produce una señal secundaria que se transporta a través del floema al ápice (óvalos amarillos), cuyo efecto es una inhibición en su crecimiento. El rectángulo naranja representa la señal que induce la Resistencia Sistémica Adquirida (RSA). La dominancia apical, mediada por el tejido vascular, se representa por flechas que simbolizan la represión de meristemos axilares. |
Como ya se ha mencionado, el floema consta fundamentalmente de dos tipos celulares, la célula aneja y el elemento criboso. Ambos se originan de una célula precursora por una serie de divisiones asimétricas y eventos diferenciativos específicos. En la figura 2 se muestra un esquema que representa este proceso en secciones longitudinales de calabaza, basado en las minuciosas observaciones de Esau. Hay evidencias del papel de las auxinas en la diferenciación del floema (debido a su papel en la elongación de células, evidente durante el desarrollo del elemento criboso), pero, debido a la dificultad de analizar este tejido (por estar embebido en otros tejidos y por carecerse de un sistema de diferenciación in vivo, semejante al de Zinnia elegans para xilema), no existe mucha información relativa a los genes involucrados en la maduración del floema. Es evidente que mutaciones nulas en genes involucrados en la formación del floema deben ser letales en etapa adulta, lo que subraya la dificultad de desmenuzar el desarrollo del floema por medio de herramientas genéticas. Sin embargo, se ha aislado una mutante cuyo floema no se desarrolla apropiadamente en Arabidopsis thaliana. El gen mutado en este caso, denominado APL, es un regulador transcripcional que inhibe además la formación de xilema; se desconoce la serie de eventos que conduce a la formación del floema guiada por este gen (5). Más recientemente, se han logrado separar floema y xilema secundarios del hipocotilo de Arabidopsis, de forma que se han analizado genes expresados específicamente en estos tejidos (6,7). Esta técnica seguramente será de gran utilidad de aplicarse en sistemas cuyo floema sea más fácilmente separable de otros tejidos.
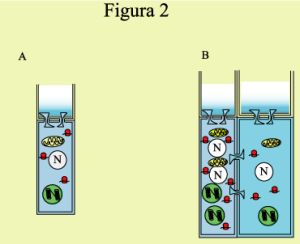 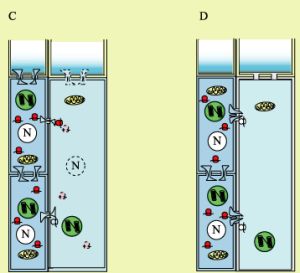 |
Figura 2. Desarrollo de la célula aneja y elemento criboso en cucurbitáceas, basado en Esau (1953). Una célula precursora del complejo comienza a dividirse de forma asimétrica (A y B). La célula precursora del elemento criboso (célula cribosa; derecha) sufre un alargamiento, mientras que la precursora de la célula aneja puede dividirse (B y C; izquierda). Posteriormente los plasmodesmos que comunican a la célula aneja con la célula cribosa sufren una modificación, dando lugar a estructuras ramificadas (C y D). Finalmente, el elemento criboso culmina su proceso diferenciativo con la degeneración del núcleo (blanco), ribosomas solubles (rojo) y los plasmodesmos que comunican elementos cribosos contiguos (azul; proceso representado con líneas discontinuas en estas estructuras). Esto resulta en la continuidad de hileras de elementos cribosos. Aparentemente, los plástidos (verde) y mitocondrias (amarillo) pueden sobrevivir el proceso degenerativo (D). Los ribosomas asociados al vestigio de retículo endoplásmico adosado a la membrana y a los plasmodesmos modificados (color blanco) de los elementos cribosos podrían permanecer funcionales. |
En la figura 3 se muestra de manera esquemática la ruta que siguen los productos de la fototosíntesis de los tejidos fuente a los consumidores a través del floema. Las células que propiamente llevan a cabo la fijación del CO2 (en el mesófilo) exportan la sacarosa a las células vecinas, la vaina del floema. De este tipo celular los fotosintatos son transportados (dependiendo de la planta) al parénquima del floema, célula aneja, elemento criboso, célula aneja del floema del tejido consumidor y células fuera del floema en dicho tejido. Los fotosintatos siguen dos rutas, a través del apoplasto (o espacio intercelular) o a través de los plasmodesmos, sin salir de las células (el denominado simplasma o simplasto). Diversos trabajos han demostrado que existen especies que transportan fotosintatos del mesófilo al floema sobre todo a través del apoplasto, mientras que otras lo hacen mayoritariamente a través del simplasma. Sin embargo, el transporte a larga distancia ocurre invariablemente en el simplasma del floema.
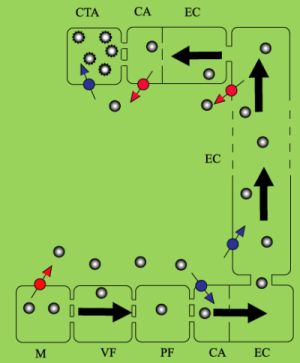 |
Figura 3. Transporte de sacarosa del mesófilo (M) de hojas fotosintéticamente activas hasta células de tejido apical (CTA). Las flechas indican la dirección del flujo. La sacarosa (círculos grises) es producida en mesófilo, de donde es transportada a través de la vaina del floema (VF), parénquima del floema (PF), célula aneja (CA) y conjunto de elementos cribosos (EC) del tejido fuente y en crecimiento. La ruta seguida, que puede variar de una especie a otra, es a través de los plasmodesmos, así como por medio de transportadores transmembranales (flechas delgadas con un círculo, rojo, als que lo exportan al apoplasto, y azul los que lo importan al interior de las células), que la traslocan al espacio intercelular o apoplasto. Las líneas discontinuas de la sacarosa en la CTA indican su metabolización; ésta y su transporte fuera del floema genera un “sifón” en el tejido consumidor. El flujo de este conducto está determinado por el retiro continuo de la sacarosa del floema, y el gradiente de concentración resultante. |
Considerando la naturaleza enucleada de los elementos cribosos, así como la probable ausencia de ribosomas solubles, es evidente que la funcionalidad del floema depende de un transporte continuo de lípidos y proteínas de membrana y solubles provenientes de la célula aneja adyacente. Además, debe existir en los elementos cribosos un sistema que mantenga el balance redox. Se ha sugerido que los elementos cribosos pueden ser considerablemente longevos (por ejemplo, 50 años en algunas monocotiledóneas), lo que ilustra la eficiencia de dicho sistema. La presencia de proteínas tales como la tiorredoxina h y citocromo b5 reductasa (8,9,10) indica la presencia de un sistema involucrado en mantener el equilibrio redox en el floema.
El análisis del contenido de exudados de floema ha permitido sugerir que no únicamente nutrientes minerales o fotosintatos circulan en el floema. Fitohormonas tales como auxinas y citocininas han sido encontradas en savia de floema (11,12). También se ha detectado ácido salicílico, una molécula indispensable para el establecimiento de la resistencia sistémica adquirida (13,14). La presencia de auxinas puede explicarse por su papel en la diferenciación del floema (particularmente en la elongación de las células precursoras de los elementos cribosos) por lo que podrían ser componentes normales de este tejido, más que transportarse larga distancia. En raiz y en ápices de brotes, las auxinas son traslocadas por el apoplasto de manera polar, por transportadores transmembranales, y regulan la distribución de los primordios de hojas que surgen del meristemo apical (15). Es posible, por tanto, que no sean transportadas larga distancia vía el floema. Conociéndose ya la identidad del elusivo receptor de auxinas (una proteína con caja F, involucrada en el recambio de proteínas de vida media corta tales como reguladores del ciclo celular; 16), será posible determinar con mayor precisión qué función juegan las auxinas en el floema. Por otra parte, si bien es cierto que algunas evidencias sugieren que las citocininas no se transportan de la raíz a la parte aérea de la planta a través del xilema (17), otros trabajos han demostrado su presencia en exudados de floema en diferentes tejidos de Sinapis alba y Arabidopsis thaliana, y más aún, un aumento en su concentración durante la inducción de la floración (11,12). Otras moléculas potencialmente señalizadoras parecen ser sintetizadas en floema secundario, como el ácido giberélico, pero también auxinas y citocininas, aunque no existe mucha información que permita asignarles un papel activo en la señalización (aparte, obviamente, de su presencia en floema y su papel en el desarrollo de este tejido; 7).
Se ha documentado la presencia de una gran variedad de proteínas en exudados de floema de diferentes especies (18). Se desprende que una importante fracción de la población de proteínas de savia de floema corresponde a aquéllas cuya función principal es la del mantenimiento de los elementos cribosos. La identidad de algunas proteínas de floema ha apoyado esta noción: tiorredoxina h, glutarredoxina y citocromo b5 reductasa, proteínas eminentemente involucradas en mantener el equilibrio redox del floema (8,9,10). El análisis del proteoma de savia de floema de Cucurbita maxima y de Cucumis sativus indica que la gran mayoría de las proteínas de savia de floema tienen un papel protector del floema y de toda la planta completa (del balance redox, contra patógenos y contra herbivoría; 19). Por otra parte, los elementos cribosos sólo presentan un citoesqueleto parietal de actina que le permite resistir la presión de turgor del floema, pero no impide el libre flujo del floema. La profilina, que impide la polimerización de filamentos de actina, es una proteína abundante en floema de Ricinus communis (20). En la mayor parte de los casos, estas proteínas se producen en la célula aneja, por lo que deben ser transportadas al elemento criboso vecino a través de los plasmodesmos. Adicionalmente, es probable que proteínas transmembranales sean transportadas a través del retículo endoplásmico y por el flujo de membrana que alimenta a la de los elementos cribosos. Proteínas de savia de floema de diferentes fuentes incluyen especies de más de 100 kDa; aún considerando un límite de exclusión sumamente generoso (hasta 40 kDa, de acuerdo con algunos autores; 21), está claro que en al menos estos casos se requiere un transporte activo a los elementos cribosos. Como se verá más adelante, una parte importante de las proteínas solubles de tubos cribosos deben ser capaces de interactuar con los plasmodesmos que comunican la célula aneja con el elemento criboso vecino. Esta propiedad recuerda a la de proteínas de movimiento viral, requeridas para el transporte intercelular de virus de plantas (22). Un aspecto importante sobre las proteínas del floema es si la dirección de su movimiento es regulado de alguna manera o es completamente pasivo. Algunos estudios han demostrado que una proporción importante de las proteínas es “retirada” del floema antes de llegar a tejidos consumidores fuertes, y otras se incorporan al flujo durante la traslocación del floema (18). Esto sugiere que el movimiento de las proteínas puede ser parcialmente regulado. Ingeniosos experimentos en los que proteínas de calabaza que se mueven larga distancia en el floema fueron marcadas y reintroducidas en el floema de arroz indican que el flujo de éstas es más bien pasivo en dirección al ápice, pero es regulado en dirección de la raíz (23).
Algunos trabajos han reportado diferentes especies de RNA en floema. Originalmente, una variedad de RNAs mensajeros fue hallada en exudados de calabaza (24,25). Más recientemente, moléculas tales como RNAs de bajo peso molecular correspondientes a RNAs interferentes, segmentos de transposones y otros, potencialmente microRNAs, han sido halladas en savia de esta planta (26). Proteínas que unen RNA tanto de bajo como alto peso molecular (26,27) indican que éstas, así como ciertos RNAs, podrían formar parte de un sistema de intercambio de información en plantas a través del floema. No obstante, debe tenerse presente que muchos de estos RNAs han sido detectados previa retrotranscripción y amplificación enzimática, de tal forma que no se puede descartar contaminación de RNAs provenientes de tipos celulares aledaños que podrían encontrarse sólo a niveles basales (25,28). Por ende, la localización de RNAs en elementos cribosos in situ debe ser un criterio adicional para asegurar que éstos se desplazan larga distancia por el floema.
Diferentes estímulos ambientales inducen la floración en plantas. La mayoría responde a un fotoperíodo (aunque no exclusivamente), es decir, un umbral de luz que es rebasado y percibido por las hojas maduras. Estas envían una señal al ápice, del que se origina la flor. Otros factores que regulan la floración son la temperatura, disponibilidad de agua o ataque por patógenos (1). Se sabe también que factores endógenos, principalmente un programa genético, regulan la inducción floral. La floración puede ser también independiente del fotoperíodo; en Arabidopsis thaliana esta respuesta es regulada por el gen FLC (29), mientras que en aquella que responde al fotoperíodo es el gen CONSTANS (30). La transmisión de una señal inductora de la floración, a través del floema, fue demostrada por medio de injertos en Xanthium strumarium y Perilla crispa, plantas cuya floración responde al fotoperíodo de manera muy precisa (1). Básicamente, se injertó la hoja de una planta ya comprometida a florecer en otra que había sido mantenida en la oscuridad. El resultado, evidentemente, fue que la hoja injertada indujo la floración del portainjerto. Diversos trabajos han tenido como objetivo aislar la señal florigénica (o florígeno, un término acuñado en la década de los 30s no muy popular entre estudiosos del tema), sin resultados convincentes. Se ha observado un aumento en la concentración de ciertos compuestos en savia concomitante a la inducción floral (11,12,31). De esta forma, fitohormonas como el ácido giberélico y citocininas, e incluso carbohidratos, han sido postulados como posibles señales florigénicas. Se ha abordado este problema con herramientas genéticas, usando mutantes que no florecen o cuya floración no responde al fotoperíodo en plantas modelo. Así, mutantes en CONSTANS son capaces de florecer, pero tardíamente, indicando que regula la floración dependiente del fotoperíodo (30). El papel del floema como generador de señales, y no únicamente conducto de las mismas, es reforzado por trabajos que han demostrado que la expresión de CONSTANS en floema en portainjertos es suficiente para inducir floración en injertos cuyo gen no es funcional; de hecho, la sobreexpresión de este gen en el ápice no conduce a floración (32,33). Estos resultados son reminiscentes de aquellos obtenidos con el gen INDETERMINATE 1, de maíz (34), cuyas mutantes no son capaces de florecer. Este gen se expresa sobre todo en la vaina del floema; considerando que codifica un activador de la transcripción (en principio), cabe especular que el floema es capaz de generar una señal (o conjunto de señales) que son transportadas al ápice como respuesta a una señal primaria. También es posible que se requiera una señal adicional que sea transportada de las iniciales del floema al meristemo, propiamente. En este punto no se puede descartar ningún candidato (fitohormona, metabolito, macromolécula, etc.). Evidentemente, la búsqueda de las señales inductoras de la floración no ha concluido.
Si bien no se ha encontrado en plantas un sistema semejante a la respuesta inmune adquirida en animales, está claro que éstas responden de manera eficiente al ataque de patógenos. Es casi un lugar común mencionar que la enfermedad en plantas (más aún las silvestres, en comparación con las cultivadas) es la excepción y no la regla. Dentro de las respuestas que contribuyen a contener la infección por patógenos está la respuesta sistémica adquirida (o RSA). Se sabe desde hace décadas que la infección por un patógeno “atenuado” o poco virulento conduce a un estado de resistencia evidente tras la posterior infección por una cepa virulenta del mismo patógeno. Por otra parte, dicha infección induce un estado de resistencia en tejidos que no han sido alcanzados aún por el patógeno, la resistencia sistémica adquirida mencionada (35). Esta es establecida por la transmisión de una señal de los tejidos inicialmente infectados al resto de la planta, siempre siguiendo el sentido del flujo del floema. El inicio de la RSA no siempre correlaciona con el flujo de fotosintatos y, por ende, del floema, lo que indica que la señal inductora de RSA podría usar otra ruta, aunque con menor frecuencia (¿el apoplasto?; 36). La RSA puede ser de amplio espectro, pudiendo ser inducida por efectores abióticos. El ácido salicílico, pariente estructural cercano de la aspirina, ha sido propuesto como la señal inductora de la RSA. Este tiene un papel importante en la inducción de genes de defensa tales como proteínas relacionadas con patogénesis (PRs) ácidas por medio de la interacción directa o indirecta con NPR1, una proteína que se trasloca al núcleo en respuesta al estallido oxidativo que ocurre tempranamente durante la infección (37). Sin embargo, existen evidencias contradictorias sobre su papel en este fenómeno. Por ejemplo, plantas transgénicas para una enzima bacteriana que lo hidroliza, usada como portainjerto, no impide la transmisión de la señal putativa para RSA; no obstante, dobles injertos “en sandwich” de plantas no productoras de ácido salicílico han demostrado que se requiere éste para el establecimiento de la RSA (38). Por otra parte, la presencia de este compuesto en exudados de savia de floema, particularmente en plantas infectadas por virus (13,14), apoya la noción del ácido salicílico como una señal móvil. Trabajos más recientes sugieren de manera convincente que la señal sistémica podría tratarse más bien de un lípido. Mutantes deficientes en RSA resultaron tener inactivo el gen para una proteína que transfiere lípidos. Dichas plantas no producen la señal móvil para la RSA, pero sí responden a señales presentes en savia de plantas silvestres (39). Evidencia adicional proviene de la caracterización de mutantes deficientes en RSA; algunas de éstas presentan genes para lipasas mutados (40). Más aún, la actividad lipolítica de las proteínas correspondientes aumenta varias veces en presencia de ácido salicílico. De acuerdo con el modelo implícito en estos resultados, una lipasa activada por ácido salicílico libera un lípido específico de una membrana (de citoplasma o de un orgánulo como el retículo endoplásmico), el que, modificado o no, es transportado a través del floema. Estableciendo un símil distante con el tejido vascular en animales, cabe especular que dicho lípido fuese movilizado conjugado con proteínas para su “solubilización”. Una proteína capaz de enlazar el lípido señal podría asemejarse, en estructura y/o función, a aquéllas que responden a, por ejemplo, glucocorticoides en animales. Será interesante determinar qué receptores podrían interactuar con la señal móvil en tejidos sistémicos.
Para su diseminación por toda la planta, los virus requieren de tejido vascular funcional, principalmente floema (pero el xilema seguramente es el conducto utilizado para virus transmitidos por vectores que habitan el suelo, como ciertos hongos). Trabajos pioneros de Esau y otros autores demostraron la necesidad de floema funcional para la transmisión de virus de hojas inicialmente infectadas al resto de la planta (2). Por mucho tiempo se consideró que los virus debían transportarse entre células vecinas de manera análoga a animales. Es decir, células que albergasen a un virus eclosionarían, liberando al virus al espacio extracelular. Células vecinas reconocerían al virus por medio de receptores y lo internalizarían. Sin embargo, la búsqueda infructuosa de dichos receptores llegó a considerar que los virus podrían desplazarse de una célula a otra a través de los plasmodesmos. Sin embargo, su límite de exclusión molecular (al menos en mesófilo) es demasiado pequeño para permitir el paso de incluso la partícula viral más pequeña (menos de 1 contra 10 kDa, en el caso del diámetro de la partícula del virus del mosaico del tabaco). Esta paradoja se resolvió, al menos en parte, con los trabajos del grupo de Lucas, quien demostró que ciertas proteínas virales, las denominadas de movimiento, aumentaban el límite de exclusión de los plasmodesmos y eran capaces de unir RNA o DNA (según el genoma del virus en cuestión) independientemente de su secuencia (41). Dicho aumento permite el transporte de virus entre células vecinas. Lo que parece ser evidente es que los virus, al interactuar con plasmodesmos y con otros factores de la planta para su diseminación sistémica, sólo aprovechan una maquinaria endógena preexistente cuya función sería el transporte de señales a través de plasmodesmos y del floema a tejidos distantes. De esta forma, y estableciendo una analogía con proteínas de movimiento viral, se ha demostrado que muchas proteínas de floema son capaces de transportarse de una célula a otra a través de plasmodesmos (22). Asimismo, se supone que están estructuralmente relacionadas con las proteínas virales ya mencionadas. Esto, considerando que deben atravesar los plasmodesmos que interconectan la célula aneja con el elemento criboso (10, 27). Las proteínas CmPP16 y CmPP36 de exudados de savia de floema de calabaza presentan epitopos comunes a los de proteínas de movimiento viral, los que en principio serían necesarios para su interacción con plasmodesmos. CmPP16, al igual que otras proteínas de exudados de floema, unen RNA de manera no específica, lo que refuerza la analogía con proteínas de movimiento virales. Además CmPP16 se trasloca a través de un heteroinjerto, sugiriendo su transporte a larga distancia. (26,27). Los viroides ilustran de manera más directa la existencia de proteínas en plantas con propiedades virales. Estos patógenos, consistentes en RNA de 250-400 nucleótidos circular, carecen de capacidad codificante y no se encapsidan, de forma que dependen completamente del huésped para replicarse, moverse de una célula a otra y a larga distancia en el floema. En efecto, se han encontrado proteínas de floema capaces de unir RNA de viroide de manera específica y transportarlos a heteroinjertos (42). No únicamente en floema existen proteínas capaces de interactuar con plasmodesmos, ya que se han identificado factores transcripcionales en ápice y en raíz con la capacidad de moverse de una célula a otra, tales como KNOTTED, LEAFY, APETALA y SHR (43,44,45). El movimiento de estas proteínas parece determinar la identidad de ciertos tipos celulares. La presencia de proteínas capaces de transportar RNA a distancia, no derivadas de virus, ha llevado a la identificación de una compleja población de RNAs en savia de floema (25,26,46). Tales RNAs corresponden tanto a proteínas potencialmente regulatorias como a RNAs interferentes de transposones, microRNAs regulatorios (25,26) incluso RNAs intraducibles o no procesados (Ruiz-Medrano, y León-Ramírez y Ruiz-Medrano, observaciones no publicadas). Sólo algunos RNAs encontrados en savia de floema son capaces de ser transportados fuera del floema en un heteroinjerto, lo que indica que el transporte dentro del floema puede ser pasivo, pero no así la salida de las moléculas de este tejido (25). Esto puede estar relacionado con la barrera invisible en el ápice que muchos virus no son capaces de atravesar. Por ejemplo, el virus del mosaico del trébol blanco no puede acceder al meristemo apical, pero la sobreexpresión del gen que codifica una proteína de movimiento viral (cuya función tiene más que ver con la supresión del silenciamiento génico; ver más adelante) le permite entrar a este tejido (47). Además, las hojas de algunas plantas que acumulan mayor cantidad de proteína viral no presentan polaridad alguna. Esto tal vez se debe a una desregulación en la función de los plasmodesmos que comunican el ápice con los primordios de órganos. Dicha comunicación es esencial para establecer la polaridad de los órganos que emergen del meristemo apical, pero se desconoce la naturaleza de las señales intercambiadas o la ruta seguida por éstas. Un microRNA necesario para establecer la polaridad de hojas es aparentemente transportado por el floema (48), sugiriendo que estas moléculas son las señales enviadas por el ápice a los primordios. Evidencia adicional apoya el papel de RNAs de floema en el desarrollo de plantas y no como contaminantes pasivos de tejidos vecinos. El RNA CmNACP1 de savia de calabaza es capaz de acceder al meristemo apical de un hetroinjerto, mientras que la proteína codificada por éste se acumula en núcleo y no se encuentra en elementos cribosos, lo que sugiere que únicamente el RNA podría tener una función señalizadora (25). Por otra parte, injertos de plantas silvestres de jitomate sobre la mutante mouse ears (u orejas de ratón, por la apariencia de sus hojas) como portainjerto desarrollan eventualmente hojas con el fenotipo mutante; esto aparentemente se debe, o al menos se correlaciona, con el transporte por floema del RNA mensajero producto del gen mutado (una fusión traduccional entre un gen homeótico-regulador del desarrollo- y otro involucrado en el metabolismo de glucosa-fosfofructocinasa dependiente de pirofosfato) del portainjerto mutante al meristemo apical del injerto silvestre (49). Resultados semejantes han sido demostrados para RNAs silvestres (46). Los viroides presentan secuencias que son necesarias para su transporte al floema, mismas que podrían presentar RNAs encontrados en exudados de savia de floema (50); este criterio podría discriminar RNAs contaminantes de aquellos que no lo son. Un aspecto importante que debe tomarse en cuenta, ya mencionado, es qué tan específico es el transporte en floema de las macromoléculas descritas en esta sección. Por otra parte, parece que la expresión de un gen en célula aneja, en este caso la proteína verde fluorescente (GFP), usada ampliamente como reportera, conduce invariablemente a la traslocación de la proteína codificada por éste al elemento criboso, y, por tanto, a su transporte a larga distancia (51,52). Esto ha llevado a sugerir que el movimiento de macromoléculas entre la célula aneja y el elemento criboso es fundamentalmente pasivo. Otros trabajos han sugerido una situación semejante para los plasmodesmos que interconectan células en mesófilo y ápice (53). Sin embargo, la situación no es tan clara si se considera que GFP es una proteína poco usual en cuanto a su estructura (cilíndrica). En adición a esto, el movimiento aparentemente no regulado de GFP en células que importan masivamente fotosintatos podría reflejar más bien un flujo continuo de macromoléculas, y no necesariamente el límite de exclusión de los plasmodesmos (53). Otras evidencias sugieren que es la fuerza de la región regulatoria de la expresión del gen reportero (promotor) en la célula aneja lo que determina que la proteína correspondiente pueda acumularse a niveles tales que se “desborde” al elemento criboso. Si se usa un promotor débil (en comparación con los usados en los estudios anteriores), GFP se acumula únicamente en célula aneja (54). Finalmente, el transporte de polímeros de alto peso molecular marcados fluorescentemente fuera del floema en el ápice y en semillas en desarrollo sugiere que éstos puede dañar a los plasmodesmos, resultando en límites de exclusión artificialmente elevados (55).
Un objetivo inicial de la producción de plantas transgénicas fue, y sigue siendo, la introducción de genes foráneos en plantas de interés agrícola que pudieran conferirle propiedades ventajosas. Muchos de estos genes provenían de la planta misma, pero se introdujeron secuencias regulatorias tales que mantuvieran al gen en cuestión encendido de manera constitutiva. Los resultados, en muchos casos, fueron decepcionantes: en muchas ocasiones el transgen parecía no estar activo. Trabajos posteriores demostraron que el gen endógeno también se inactivaba, fenómeno denominado cosupresión, o silenciamiento génico (56,57). Por otra parte, el fenómeno de protección cruzada, en el que una cepa poco virulenta de un virus era preinoculada a una planta para inducir un estado de elevada resistencia contra cepas más virulentas del mismo virus, se comenzó a abordar por medio de ingeniería genética. Se especulaba que la proteína de la cubierta era responsable de encender mecanismos de defensa, pero en este caso éstos parecían ser sumamente específicos contra una especie particular de virus. Por tal razón se usaron plantas expresando la proteína de la cubierta de algunos virus de RNA (58). Trabajos del grupo de Dougherty mostraron que la resistencia podía ser tan notable, e incluso superior, utilizando versiones no traducibles del gen de la proteína de la cubierta de un virus específico, el virus del jaspeado del tabaco (59). Lo más llamativo del caso fue que el transgen estaba activo transcripcionalmente, pero los RNAs mensajeros sintetizados eran degradados tan pronto eran transportados al citoplasma. Este trabajo mostró la existencia de un sistema de defensa contra virus de RNA (pero también de DNA) basado en la degradación de RNAs específicos. Evidencia adicional sugirió que la cosupresión y el silenciamiento de virus podrían estar relacionados o ser parte de un mismo fenómeno. Lo aparentemente estocástico del proceso impidió que se estudiara con detalle, hasta que el grupo de Vaucheret lo analizó cuidadosamente. La sobreexpresión de nitrato reductasa de tabaco en esta planta causó, como era de esperarse, el silenciamiento del gen endógeno y del transgen (60, 61). En este caso, el fenotipo de las plantas silenciadas era fácilmente identificable y rastreable: las plantas se tornaban blancas, por la destrucción de cloroplastos. De esta forma se observó que la decoloración de las hojas comenzaba en hojas maduras, alrededor de las venas, y se diseminaba a hojas jóvenes. Esto sugería que el silenciamiento postranscripcional no aparecía de manera espontánea, y que estaba asociado de alguna forma al floema. Posteriormente, experimentos con injertos demostraron que el silenciamiento génico postranscripcional se propaga al resto de la planta a través del floema. Más recientemente, se ha demostrado que exudados de savia de floema contienen RNAs de bajo peso molecular (entre 21 y 23 nucleótidos), que, como ha sido demostrado en sistemas animales, desencadenan PTGS y provienen de la degradación de RNA aberrante destinado a ser degradado (26). Estos RNAs se consideran las señales móviles que desencadenan el silenciamiento. En resumen, el floema juega un papel fundamental en la transmisión de la señal que induce silenciamiento pero es evidente que también está involucrado en la amplificación de la señal. Que su papel no se limita al de un conducto pasivo se desprende de la existencia de proteínas con capacidad de enlazar RNAs de cadena sencilla y doble de 21-23 nt, las potenciales señales para el silenciamiento. Dichas proteínas son capaces de interactuar con plasmodesmos y transportar dichos RNA de una célula a otra, pero no a RNAs de PM mayor. Se desconoce si tales proteínas son sintetizadas en otros tejidos, pero es posible que sean únicas al floema (26).
Si el silenciamiento génico es una estrategia de protección contra virus, algunos han desarrollado (dicho esto teleológicamente) contraestrategias para permitir su replicación y diseminación en plantas, ya sea impidiendo la producción o bien el transporte local y en floema de la señal que induce silenciamiento por medio de supresores del silenciamiento. La sobreexpresión de algunas de estas proteínas tiene un efecto dramático en el desarrollo de plantas. Esto se debe a que interfieren con la síntesis o transporte de microRNAs involucrados en el desarrollo (62). Esto a su vez indica que el fenotipo observado en plantas infectadas con virus capaces de suprimir silenciamiento puede deberse en buena medida a la acción de estas proteínas.
Este fenómeno resulta de la incapacidad de meristemos axilares de desarrollarse por la represión de un meristemo apical principal. Aparentemente, dicho efecto está mediado por auxinas, pero éste parece ser indirecto (1). Evidencia adicional sugiere que otras moléculas podrían también estar involucradas en mantener dicha represión (que resulta en la dominancia apical). Mutantes que no presentan dominancia apical en Pisum sativum pueden restablecerla si son injertadas sobre plantas silvestres, provisto que posean hojas fotosintéticamente activas, lo que implica al floema en la transmisión de una señal que establece la dominancia apical (63). Otras mutantes en dominancia pueden recuperarla si se injertan sobre raíces silvestres, lo que indica que señales involucradas en mantener la dominancia apical pueden transportarse tanto en floema como xilema; esto implicaría a las citocininas, que se transportan por esta vía (64). Sin embargo, estos trabajos han demostrado también que existen otras señales aparte de las citocininas, las que podrían influir en este fenómeno. Trabajos adicionales han demostrado que otras mutantes en dominancia apical presentan más bien defectos en la percepción de auxinas, y ésta puede ser restablecida por la expresión del gen AXR1 (involucrado en la percepción de auxinas) en xilema o esclerénquima, pero no floema, mostrando que el efecto de las auxinas es indirecto, y, además, que no parecen salir del floema (65).
Las plantas son capaces de adaptarse a condiciones de falta de agua, siempre y cuando el agobio no sea excesivo. Una de las respuestas primarias se ha estudiado con detalle, consistente en el cierre de estomas (que conduce a una disminución en la pérdida de agua por transpiración). Esta respuesta se debe a la acción del ácido abscísico, que por medio de receptores específicos actua sobre canales iónicos, los que a su vez aumentan el volumen de las células oclusivas (y resultando en el cierre de estomas; 1). Una respuesta más lenta pero con mayor valor adaptativo es, por regla general, una disminución del crecimiento de la parte aérea de la planta relativo al de la raiz para (desde un punto de vista teleológico) favorecer el crecimiento de ésta y aumentar la probabilidad de encontrar agua. Se sabe que la cofia de la raíz responde a una mayor dureza del suelo (y, por ende, a menor cantidad de agua en suelo) con la producción de ácido abscísico. Este es transportado por el xilema de la raíz particularmente a las hojas con mayor tasa de transpiración (que son las fotosintéticamente maduras). La respuesta primaria al ácido abscísico es, como se ha mencionado, el cierre de estomas. Se ha propuesto que el ácido abscísico induce la producción de una señal secundaria, que es transportada a través del floema de las hojas maduras al ápice y a las raíces. El resultado neto es una disminución en el crecimiento de la parte aérea con respecto a las raíces. Se desconoce la naturaleza de las señales involucradas, pero es probable que dichas señales detengan el ciclo celular de las células del meristemo apical, mientras que no lo inhiban en los meristemos de la raíz. No es de extrañar que se haya encontrado a un inhibidor de ciclinas dependientes de kinasa inducido por ácido abscísico, que a su vez es la señal que se trasloca por el xilema en respuesta a sequía (66).
Una vez en la corriente de traslocación del floema, la señal potencial debe llegar hasta el meristemo apical. Esto no es tan trivial si se considera que las células iniciales del floema pueden estar apartadas del meristemo por cientos de células. La ruta que siguen las señales provenientes del floema se desconoce, pero hay únicamente dos posibilidades: transporte a través del apoplasto o través de plasmodesmos. La ruta que siguen los azúcares producto de la fijación de carbono en el ápice puede sugerir la utilizada por dichas señales; en este caso, parece ser casi exclusivamente a través de los plasmodesmos, es decir, su transporte es simplásmico (1). Como ya se ha mencionado, factores transcripcionales como LEAFY y KNOTTED son capaces de desplazarse entre células vecinas en el meristemo apical a través de los plasmodesmos. Es posible que señales provenientes del floema induzcan el movimiento, al salir de las células iniciales del floema, sin tener que desplazarse hasta el meristemo apical propiamente. Evidentemente, este escenario es completamente especulativo, y no se puede descartar que las señales que viajan en floema pueden llegar hasta el meristemo apical. Es pertinente mencionar que en el meristemo apical ocurre transporte de señales a través del espacio extracelular. Un ejemplo de ello es el gen CLAVATA3, involucrado en el mantenimiento del meristemo apical. Este gen especifica un péptido secretado al apoplasto cuya función es impedir la diferenciación de las células del meristemo apical (67). Las mismas auxinas constituyen otro ejemplo de señales transportadas y percibidas en el apoplasto en el ápice y en otros tejidos. Por otra parte, durante la inducción de la floración en Arabidopsis ocurre un cambio en la permeabilidad de los plasmodesmos del meristemo apical. Así, la microinyeccón de células adyacentes al domo apical con compuestos fluorescentes de bajo peso molecular (700 Da, usados como indicadores de apertura de plasmodesmos) resulta en su exclusión de este tipo celular al iniciar este proceso (68). Esto sugiere que el transporte de ciertas señales al ápice a través de plasmodesmos de manera continua reprime la floración, y en su ausencia ésta puede proceder. Otra vez de manera especulativa, la señal proveniente del floema podría inducir el cierre de plasmodesmos que interconectan células del meristemo apical, transitoria o permanentemente. Otros resultados ya citados permiten apreciar la importancia de la regulación del límite de exclusión de los plasmodesmos del ápice; si éstos permanecen (aparentemente) abiertos de forma continua (por acción de una proteína viral; 47), no se puede establecer la polaridad de las hojas. Si bien esto puede ser un efecto indirecto de la sobreexpresión de una proteína viral, otra interpretación del fenómeno sugiere que las señales inductoras de la polaridad de los órganos se transportan a través de los plasmodesmos. Esto coincide en principio con la acción propuesta para un microRNA que especifica polaridad de hojas (48). Estos trabajos en suma sugieren que moléculas señalizadoras pueden desplazarse en el ápice a través de plasmodesmos, pero no está claro si moléculas provenientes del floema son capaces de acceder hasta el meristemo apical. Los virus en su gran mayoría no tienen acceso al meristemo apical, pero se desconocen los mecanismos por el que son excluidos. Sin embargo, ciertos RNAs de floema pueden llegar al meristemo apical; la presencia de un RNA en elementos cribosos no garantiza, entonces, su salida del floema, al menos no en tejidos apicales (25). Cabe esperar que ciertas secuencias o características estructurales de algunos RNAs de floema permitan su transporte hasta el meristemo apical, de manera similar a la secuencia que presentan los viroides que les permite llegar al floema (50).
Se desconoce hasta qué punto el desarrollo de la planta depende del floema, aparte del caso obvio de la distribución de nutrientes, pero los casos anteriores indican que el floema juega un papel primordial en la homeostasis de plantas. Las algas obtienen nutrientes por absorción del medio que las rodea, mientras que las plantas vasculares, y en general todas las plantas terrestres, presentan estructuras especializadas en la obtención y transporte de nutrientes (células fotosintéticas, tejido vascular, etc.). Desde un punto de vista evolutivo, parece estar claro que el surgimiento del floema y el xilema fue un prerrequisito para la colonización de ecosistemas terrestres por parte de las plantas (1). Por todo lo anterior es difícil subestimar la importancia del floema. Un trabajo reciente ha demostrado una función adicional del floema, que puede tener implicaciones en la evolución de las plantas. La infección por patógenos (en este caso, de virus de RNA) induce no sólo RSA, como se describió en una sección anterior, sino que se estimula la producción de una señal, que se transporta a través del floema de hojas maduras inoculadas con virus a hojas jóvenes, capaz de inducir recombinación heteróloga en el DNA (69). De manera especulativa podría proponerse que un patógeno induce la generación de variación obviamente no sólo en hojas jóvenes, sino en el ápice, que da lugar a progenie cuyo genoma podría presentar novedades con respecto a sus progenitores. De esta forma, los patógenos podrían influir directamente en la generación de variación en plantas, un fenómeno en el que, vale la pena recalcarlo, el floema tiene un rol fundamental. Fenómenos que aguardan una interpretación a nivel molecular, como la variación somaclonal, podrían estar relacionados con la recombinación sistémica.
En resumen, el floema es un conducto por el que se establece la comunicación entre tejidos distantes, pero es también un generador importante de señales distribuidas a otros tejidos. El análisis de la generación y transporte de estas señales utilizando diferentes herramientas (fisiológicas, bioquímicas, moleculares y genéticas) contribuirá a entender de manera precisa el papel del floema en la homeostasis y desarrollo de las plantas.