La microencapsulación de células es una estrategia terapéutica que facilita el tratamiento de un gran número de enfermedades crónicas sin la necesidad de inmunosupresión. Para lograr este objetivo, es necesario inmovilizar células que liberen moléculas con actividad terapéutica en microcápsulas poliméricas convenientemente diseñadas, de forma que se asegure la funcionalidad del injerto a medio-largo plazo. En los últimos años, los avances realizados en campos como la biología, genética y la tecnología farmacéutica han permitido desarrollar líneas más estables y resistentes y materiales más sofisticados, lo que ha permitido avanzar significativamente en la optimización de la tecnología. En la presente revisión se repasarán los últimos avances junto con las limitaciones que quedan por superar.
La posibilidad de transplantar cualquier tipo célula y protegerla frente a la respuesta inmune del huésped con el fin de recuperar la funcionalidad de tejidos y órganos dañados o simplemente como sistema de liberación de productos terapéuticos a largo plazo, ha sido objeto de un gran interés por parte de la comunidad científica. Ya en la década de los años 30, diferentes investigadores observaron el hecho de que el injerto a transplantar debía ser aislado de alguna forma frente el sistema inmunológico del huésped receptor sin que este proceso afectara la viabilidad y actividad de las células o tejido implantado. Uno de los primeros ensayos llevado a cabo por el doctor Bisceglie consistió en introducir células tumorales de ratón en membranas poliméricas y transplantarlas en la cavidad abdominal de cerdos. Los resultados obtenidos demostraron que el injerto era capaz de sobrevivir sin ser destruido por la respuesta inmune del huésped (1).
Décadas más tarde se introdujo el concepto de encapsulación como alternativa tecnológica para la inmunoprotección del injerto y su transplante en ausencia de inmunosupresión farmacológica (2,3). En este procedimiento, diferentes células, tejidos o enzimas son incorporados en matrices poliméricas recubiertas por una membrana semipermeable que permite el tránsito de nutrientes, oxígeno, desechos celulares y productos terapéuticos secretados por las células, mientras que impide la entrada de moléculas y células inmunocompetentes (4). De igual forma, las cápsulas se encargan de proteger el contenido celular interno de posibles riesgos derivados del proceso de manipulación o transplante, permitiendo que las células sobrevivan y secreten el producto deseado. Teniendo esto en cuenta, una sola administración del producto sería suficiente para tratar al paciente durante largos periodos de tiempo, evitando posologías complejas y múltiples (5).
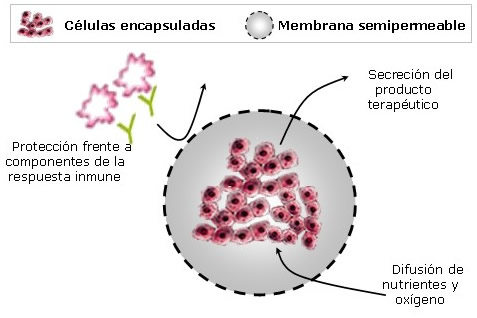
La optimización tecnológica del proceso de microencapsulación ha permitido la fabricación de matrices celulares de diferente tamaño y composición de forma que el espectro de acción de la estrategia terapéutica se ha visto significativamente aumentado. Así la gran versatilidad de esta estrategia permite que las células encapsuladas puedan emplearse tanto para tratamientos localizados (tumores sólidos), regionales (cerebro) como sistémicos (diabetes).
En líneas generales, la tecnología de inmovilización de células requiere la optimización y perfecta combinación de dos componentes principales: las células y las microcápsulas. Para ello, no solo es necesario seleccionar y estudiar cada componente por separado sino también evaluar la interacción célula-biomaterial y por lo tanto célula-microcápsula, de forma que el injerto inmovilizado permanezca activo y funcional durante largos periodos de tiempo.
La selección de la línea celular terapéuticamente activa es un criterio esencial para lograr un sistema terapéutico eficaz. De forma ideal, la línea celular debe ser fácil de cultivar y de proliferar in vitro pero ha de presentar baja o nula capacidad de proliferación una vez encapsuladas, de forma que la bioseguridad del sistema sea óptima (6). Para ello, los ensayos iniciales en modelos experimentales pueden llevarse a cabo con clones estables generalmente de mioblasto o fibroblasto, ya que estas células presentan las propiedades antes mencionadas. El gran avance de la genética ha permitido el uso habitual de células manipuladas genéticamente, de forma que hoy en día somos capaces de manipular una célula para que secrete el trasgén que nos interese (7). A este abanico de posibilidades ha de sumársele el desarrollo del campo de células madre y células primarias cuyo uso en sistemas de inmovilización ofrece también innumerables posibilidades terapéuticas pero cuya manipulación y cultivo se hace lógicamente más complejo. Un aspecto a tener en cuenta es la capacidad de producción de del clon celular ya que una mayor capacidad del clon permitirá dosificar las cápsulas con una menor densidad celular, lo que en su caso también hará que el número de cápsulas a implantar sea significativamente menor (8).
El segundo de los aspectos y no menos importante se refiere a la matriz o sistema de inmovilización celular. En este sentido, se hace necesario seleccionar correctamente los biomateriales que van a constituir tanto el núcleo como la cubierta de la microcápsula (9). Un gran número de polímeros naturales y sintéticos han sido empleados en el desarrollo de la matriz. La biocompatibilidad del biomaterial, es decir, la capacidad de un material de no inducir respuesta inmune en el huésped una vez implantado, es un criterio fundamental de estudio a la hora de seleccionar el material más interesante. Entre los biomateriales mas empleados destaca el alginato, un polímero natural procedente de las algas y con excelentes propiedades de biocompatibilidad y atoxicidad. El alginato es un polisacárido natural compuesto de dos unidades monoméricas, el ácido-β-D-manurónico (M) y el α-L-gulurónico (G) (10). La presencia mayoritaria de uno u otro monómero repercute ostensiblemente en las propiedades fisicoquímicas, mecánicas y de gelificación de los alginatos. Este hecho, unido a la gran variedad de alginatos existentes, ha suscitado un debate acerca de la composición más adecuada para la elaboración de las cápsulas. Mientras que determinados grupos de investigación sostienen que los alginatos ricos en unidades G son los más idóneos (11), otros prefieren los ricos en monómeros M (12). Es muy posible que esta controversia se deba a la falta de una definición globalmente aceptada del alginato rico en unidades G así como de una mayor estandarización en el tipo y geometría de las cápsulas empleadas en los ensayos experimentales realizados. Por otra arte, una tendencia reciente en el área de encapsulación celular es el de la búsqueda de nuevos materiales y el diseño de nuevas microcápsulas que mejoren las propiedades de estabilidad mecánica y garanticen la viabilidad de las células durante largos periodos de tiempo. En la Tabla 1 se recogen algunos de estos intentos.
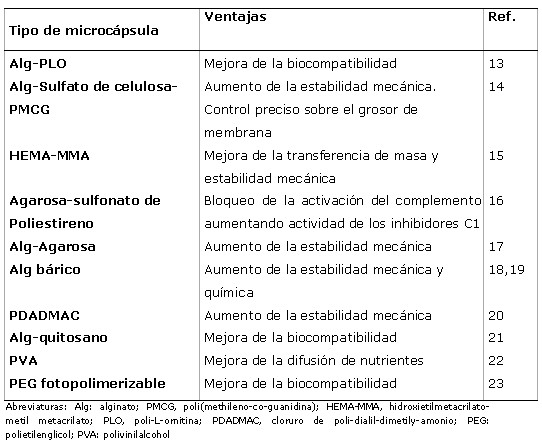
Tabla 1. Ejemplos de nuevos materiales y tipos de microcápsula en estudio para la inmovilización de células.
El análisis y purificación de los materiales a emplear es por tanto una de las áreas más importantes a desarrollar y potenciar en el campo de la tecnología de microencapsulación (24). Con este fin, hemos desarrollado y optimizado recientemente un conjunto de ensayos para determinar el grado de biocompatibilidad tanto de alginatos con diferentes propiedades como de microcápsulas elaboradas con los diferentes alginatos. Entre estos ensayos, destacan los ensayos de actividad mitogénica y de la producción de TNF-α por parte de los polímeros y de las cápsulas, que han permitido demostrar diferentes niveles de biocompatibilidad en función principalmente del grado de pureza del alginato (25).
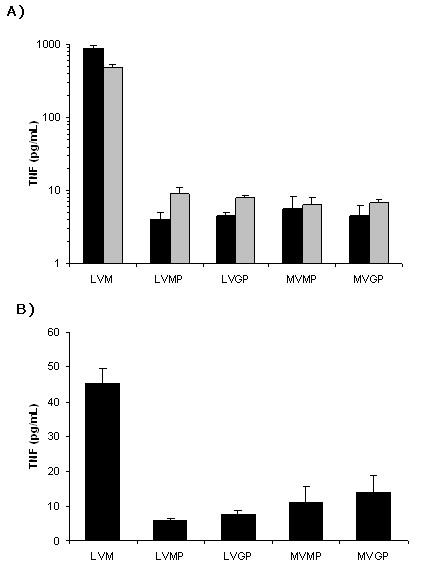
Figura 2. Producción de TNF-α por parte de macrófagos estimulados por diferentes alginatos (A) y microcápsulas elaboradas con los diferentes alginatos (B). Descripción de los alginatos: LVM: alginatos de pureza media; LVMP: alginatos de baja viscosidad, con composición predominante de ácido manurónico y elevada pureza; LVGP: alginatos de baja viscosidad, con composición predominante de ácido gulurónico y elevada pureza; MVMP: alginatos de media viscosidad, con composición predominante de ácido manurónico y elevada pureza; MVGP: alginatos de media viscosidad, con composición predominante de ácido gulurónico.
Además del biomaterial, las microcápsulas incorporan por lo general un policatión para la fabricación de la membrana semipermeable. A lo largo de los últimos años, la poli-L-lisina ha sido el policatión más frecuentemente empleado en el diseño de la membrana externa (26,27). Gracias a las características intrínsecas de la membrana, los nutrientes y el oxígeno penetraran en la cápsula, mientras que los desechos y productos terapéuticos de interés difundirán al exterior. En cambio, los receptores de la células T no podrán interaccionar con los antígenos de superficie de las células protegidas y las inmunoglobulinas y el complemento quedarán parcialmente impedidos gracias a los poros de la membrana, disminuyendo o incluso reduciendo totalmente su poder citotóxico.
Criterios tecnológicos adicionales son el diseño uniforme y reproducible de las microcápsulas y la estabilidad mecánica del sistema farmacéutico. Precisamente la evaluación de la resistencia mecánica es otro aspecto fundamental en la fabricación de las matrices celulares. La determinación de la resistencia y el comportamiento de la cápsula a lo largo del tiempo permitirán obtener matrices suficientemente resistentes como para soportar las posibles rupturas derivadas de la manipulación, administración, estrés osmótico, golpes mecánicos, movimientos del huésped, etc. Por último pero no por ello menos importante es el criterio de bioseguridad de las microcápsulas, ya que es prioritario que las cápsulas impidan la salida de las células terapéuticas inmovilizadas y por lo tanto se evite el riesgo de un crecimiento incontrolado de las mismas (28,29). En este sentido, se están manejando diversas estrategias como la de emplear alginatos biomiméticos que interaccionen con las células favoreciendo su diferenciación y adhesión a la matriz o procedimientos genéticos para inhibir la secreción del producto terapéutico o incluso inducir en cualquier momento la apoptosis celular.
Optimizado el proceso de microencapsulación y seleccionadas las células, se ha de proceder a evaluar el comportamiento de las células inmovilizadas. El estudio a medio largo plazo de la viabilidad y producción de las células inmovilizadas en cultivo así como el comportamiento y estabilidad de las matrices in vitro son aspectos esenciales previos al ensayo en animales de experimentación. En esta fase previa se decidirá la dosis ideal que garantice una óptima respuesta terapéutica y posteriormente, se procederá a la administración de las partículas para lo cual se deberá decidir vía y número de administraciones.
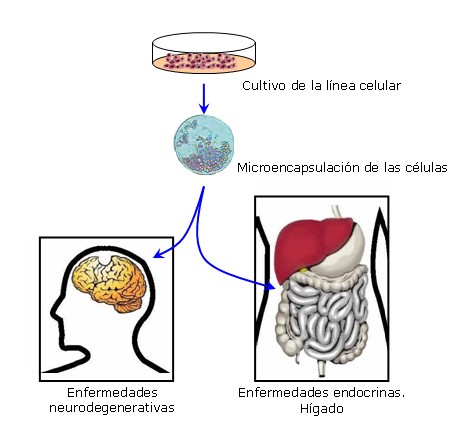
Figura 3. Proceso de microencapsulación de células y su transplante para el tratamiento de diferentes patologías
Previo a la inmovilización de células terapéuticamente activas, se hace aconsejable ensayar la respuesta a medio-largo plazo de microcápsulas elaboradas con diferentes materiales y células de interés de forma que en función de los resultadosse pueda seleccionar un sistema ideal para el posterior transplante de las células (30). En un trabajo reciente, pudimos comprobar como la administración de cápsulas elaboradas con dos tipos de alginato y diferentes policationes (poli-L-lisina, poli-D-lisina y poli-(metilen-co-guanidina) evitaba la activación de la respuesta inmune del huésped y permitía la recuperación un mes después de su implante de aproximadamente el 90% de las partículas. No obstante, también se puede comprobar la formación de fibrosis con el empleo de uno de los policationes, concretamente de la poli(metilen-co-guanidina), lo que indica la falta de biocompatibilidad del sistema (Figura 4) (resultados enviados para su publicación).

Figura 4. Recuperación de microcápsulas elaboradas con dos tipos de alginatos un mes después de su administración. (A) Porcentaje de recuperación y grado de fibrosis alrededor de las cápsulas. (B) Histología de las cápsulas retiras del huésped y teñidas con toluidina. Es posible apreciar un desarrollo fibrótico alrededor de algunas cápsulas.
Otro aspecto relevante es el tipo de implante que se haga, ya que el hecho de que el injerto sea autólogo, alogénico o xenogénico tiene implicaciones inmunológicas muy diferentes. En el caso de que se microencapsulen aloinjertos, debido a que el mecanismo defensivo en estos casos está mediado por linfocitos T (CD8+), el aislamiento físico que supone la cápsula facilitará que el implante no sea rechazado por la respuesta inmunológica del huésped. En cambio, si es un xenoinjerto lo que se pretende encapsular y transplantar, la respuesta generada es mucho más compleja ya que se estimula la formación de anticuerpos y se activa el complemento. Además, en este tipo de implantes, algunas moléculas pequeñas del injerto, que actuarían como antígenos, podrían difundir de la cápsula y provocar respuestas inflamatorias importantes. Por otro lado, la secreción de citoquinas, óxido nítrico y radicales libres por parte de las células inflamatorias, unida a la presencia de numerosos fibroblastos que rodean las cápsulas implantadas pueden provocar la muerte de las células inmovilizadas y el consiguiente fallo del injerto (31-33). Es por ello, por lo que la tecnología de células microencapsuladas ofrece mejores resultados en transplantes alogénicos y no tanto en xenogénicos, cuya implicación ética además está en seria consideración.
La versatilidad de la tecnología de células microencapsuladas ha posibilitado su estudio en un gran abanico de patologías tal y como se resume a continuación:
Son muchos los intentos que se han llevado a cabo para crear un “páncreas bioartificial”, en la mayoría de los cuales, se han inmovilizado islotes de Langerhams en microcápsulas de alginato. Los buenos resultados obtenidos tanto en roedores (34) como en animales superiores (35,36) impulsaron a mediados de la década de los 90, la realización del primer ensayo clínico en humanos. El único paciente incluido en este estudio no necesitó la administración de insulina exógena durante un mes, redujo considerablemente sus niveles de albúmina sérica glicosilada y hemoglobina A1C, mejorando también la sintomatología ligada a su neuropatía periférica (37). Si bien esta primera aproximación clínica no resultó un completo éxito, si que abrió la vía a nuevos intentos encaminados a mejorar las principales limitaciones observadas, como fueron la perdida progresiva de viabilidad de los islotes encapsulados y la falta de una completa biocompatibilidad de las microcápsulas transplantadas.
A lo largo de los últimos años, la experimentación dirigida a desarrollar un sistema fisiologico de secreción de insulina a partir de islotes encapsulados se ha intensificado. Diversos grupos de investigación han estudiado la posibilidad de promover la vascularización del implante por medio de la liberación de VEGF (factor de crecimiento del endotelio vascular) (38) y FGF (factor de crecimiento de fibroblastos) (39). Por otra parte, se ha iniciado un nuevo ensayo clínico en Italia en el que se pretende evaluar la eficacia y seguridad de islotes inmovilizados en cápsulas de alginato-poli-L-ornitina-alginato (40).
Las enfermedades del sistema nervioso central se caracterizan por el deterioro continuo de las funciones cognitivas y motoras, dando lugar a una pérdida progresiva de las células nerviosas tanto de forma crónica (caso del Parkinson, Alzheimer o enfermedad de Huntington) como aguda (traumas en cerebro o médula ósea). Una de las estrategias terapéuticas estudiadas para aliviar o retrasar la perdida neuronal es la administración de factores neurotróficos que aumenten la supervivencia de la neuronas enfermas. El GDNF (factor neurotrófico derivado de células gliales) es uno de estos factores, particularmente eficaz en la enfermedad de Parkinson. Para demostrar este fin, hemos desarrollado en nuestro laboratorio microcápsulas de tamaño reducido (300-350 μm) con el objeto de inmovilizar fibroblastos secretores de GDNF y ensayarlos en ratas parkinsonizadas. Los resultados logrados hasta el momento demuestran una reducción significativa de las rotaciones en los animales, detectándose el efecto terapéutico tan solo 15 días después del implante de las cápsulas y manteniéndose durante más dos meses (resultados sin publicar).
En el caso de la enfermedad de Huntington, el CNTF (factor neurotrófico ciliar) es el factor trófico de mayor eficacia. En un excelente trabajo realizado por Emerich y col., se demostró que el implante de cápsulas con fibroblastos secretores de CNTF en monos, ejercía un efecto neuroprotector sobre diversas poblaciones estriatales como neuronas colinérgicas y GABAérgicas, lo que respalda la idea de que este factor pueda ayudar a prevenir la degeneración de las poblaciones neuronales dañadas en esta patología (41).
Otra posible estrategia terapéutica consiste en administrar de forma continua el neurotransmisor deficitario en la enfermedad. En este sentido numerosos grupos de investigación han centrado sus esfuerzos en administrar dopamina en animales e individuos enfermos de Parkinson. En una de estos estudios, se implantaron células PC12 encapsuladas y secretoras de L-dopa y dopamina en el cerebro de monos, observándose una clara mejoría en la motricidad de los animales durante los 12 meses que duró el efecto del implante (42). Otra alternativa para la secreción continua de dopamina es la propuesta por la empresa Titan Pharmaceuticals, que en abril de este año anunció los resultados de su ensayo clínico en fase I/II con un producto basado en la inmovilización de células pigmentarias de retina secretoras de dopamina en vehículos gelatinosos (http://www.titanpharm.com). Adicionalmente, se están llevando a cabo estudios con el fin de incorporar en la microcápsula vitaminas o antioxidantes que mejoren sustancialmente el ambiente interno de las microcápsulas permitiendo prolongar la viabilidad de las células inmovilizadas.
La complejidad de esta patología ha hecho que el tratamiento con células encapsuladas se aborde desde diferentes perspectivas. Entre ellas, destaca el ensayo clínico en fase I/II realizado sobre 14 pacientes con cáncer pancreático. En este trabajo se emplearon células encapsuladas y genéticamente modificadas que expresaban la enzima citocromo P450, para la activación de bajas dosis de ifosfamida de forma localizada, lo que evitaba los efectos secundarios sistémicos del fármaco. Los resultados reflejaron que el grupo tratado con cápsulas duplicaba su supervivencia en relación al grupo control y no presentaba ningún tipo de efecto secundario (43).
Otra estrategia interesante es la inmunoterapia mediante la vectorización del agente terapéutico hacía el foco tumoral. Con este fin, un grupo canadiense encapsuló mioblastos C2C12 transfectados para secretar un complejo formado por interleuquina-2 y la región Fv de un anticuerpo humanizado con gran afinidad por tumores HER-2/neu. Los resultados observados durante las 2 semanas de estudio demostraron que en los animales tratados se producía un mayor nivel de apoptosis y necrosis tumoral (44).
Por último, se han publicado numerosos trabajos basados en la antiangiogénesis o inhibición de la angiogénesis tumoral (45). Esta estrategia antitumoral se basa en impedir la formación de un nuevo plexo vascular que irrigue al tumor, evitando así la llegada de nutrientes, oxígeno y factores paracrinos. Una de las posibles estrategias para lograr este objetivo es la de secretar factores anti-angiogénicos como la endostatina. Precisamente, el gen de este péptido se transfectó en células epiteliales de riñón que posteriormente fueron inmovilizadas en microcápsulas de alginato. Los dos grupos de investigación que emplearon esta misma estrategia terapéutica, implantaron las cápsulas cerca del foco tumoral y comprobaron en ambos casos como el tamaño del tumor se reducía en más del 70%, aumentando considerablemente la apoptosis intracelular (46,47). En otro trabajo, nuestro grupo de investigación estudió una nueva estrategia antiangiogénica basada en el bloqueo de la unión entre caderinas del endotelio vascular (caderinas-VE). Estas proteínas juegan un papel destacado en procesos como la inflamación y la unión entre células endoteliales, principales constituyentes de los vasos sanguíneos. Empleando hibridomas microencapsulados secretores de anticuerpos monoclonales dirigidos contra la caderina-VE, se observó una inhibición en la formación de microtúbulos, futuros vasos sanguíneos, in vitro de más del 85% (17).
La microencapsulación de células representa una alternativa en el desarrollo de sistemas citomédicos que liberen de forma controlada el producto terapéutico y un hito en el transplante de tejidos sin el requerimiento de las dosis habituales de inmunosupresores. Si bien son muchos los retos por alcanzar, incluyendo una normativa oficial para el desarrollo e investigación en humanos, un mayor grado de biocompatibilidad, reproducibilidad y duración de los sistemas tras su transplante en huéspedes, un correcto escalado de la tecnología a nivel industrial y un mayor grado de confianza y financiación pública, el avance continuo de disciplinas científicas como la genética, biología y tecnología farmacéutica pronostican que la tecnología de encapsulación de células podrá en un futuro ser empleada eficazmente en el tratamiento de determinadas patologías crónicas.