La familia de GTPasas Rho/Rac constituye un subgrupo numeroso dentro de la superfamilia de proteínas Ras. Actualmente se conocen más de una docena de miembros de esta familia en mamíferos, los cuales se clasifican en función de homologías estructurales en cinco subfamilias, las GTPasas RhoBTB, Rac, Cdc42, Rho, Rnd y Miro ( Figura 1 ). De todas estas, las subfamilias Rac, Cdc42 y Rho son las más caracterizadas estructural y funcionalmente. Estas proteínas se encuentran presentes en todos los eucariotas y controlan una amplia variedad de procesos celulares, ya que conectan la activación de receptores de membrana con múltiples rutas intracelulares de señalización. Como todos los restantes miembros de la superfamilia Ras, la mayoría de GTPasas Rho/Rac funcionan como “interruptores moleculares”, ciclando entre un estado inactivo, en el que se encuentran unidas a GDP, y un estado activo, en el que se hallan unidas a GTP ( Figura 2 ) 1,2 . El intercambio de GDP por GTP está regulado catalíticamente por dos grupos de moléculas de señalización, los factores de intercambio de nucleótidos (que catalizan la estimulación de las GTPasas) y las proteínas que estimulan la hidrólisis del GTP unido a las GTPasas (y que, por tanto, facilitan su inactivación al final del periodo de estimulación) 1,2 ( Figura 2 ). Estos dos grupos se conocen habitualmente a través de sus acrónimos ingleses GEF y GAP ( g uanosine nucleotide e xchange f actor y G TPase a ctivating p rotein , respectivamente). Junto a este tipo de regulación estándar, las GTPasas Rho/Rac poseen también mecanismos de regulación idiosincráticos. Así, su actividad está también controlada por las moléculas Rho GDI ( G DP d issociation i nhibitors ), unas proteínas que mantienen a las proteínas Rho/Rac inactivas secuestradas en el citosol ( Figura 2 ) 3-5 . Además, se han descrito procesos de regulación dependientes de la modulación de la expresión diferencial de las GTPasas a través de cambios transcripcionales (v. gr. RhoG, RhoB) 6,7 , cortes por caspasas (p. ej., Cdc42) 8 o de degradación por la ruta de la ubicuitina (p. ej., RhoA) 9 .
Inicialmente, esta familia de proteínas fue descubierta durante la búsqueda de oncogenes similares a Ras. Desde entonces, se ha visto que estas GTPasas modulan múltiples respuestas biológicas que, cuando se desregulan, contribuyen a múltiples patologías de interés en humanos. Entre los procesos biológicos regulados por las proteínas Rho/Rac se incluyen la modulación del citoesqueleto de actina, el establecimiento de la polaridad celular, procesos endocíticos y de tráfico vesicular, ciclo celular, diferenciación y transcripción génica. Dado el interés actual existente sobre estas GTPasas, existen múltiples revisiones excelentes sobre diferentes aspectos de su estructura, regulación y funciones 10-14 . En este trabajo, por tanto, nos circunscribiremos a dar una visión general sobre las funciones principales de estas proteínas y sobre su implicación en procesos patofisiológicos. Dado que las GTPasas de las subfamilias RhoBTB y Miro están todavía poco caracterizadas, nuestra discusión se centrará en los subgrupos de las proteínas Rac, Rho y Cdc42.
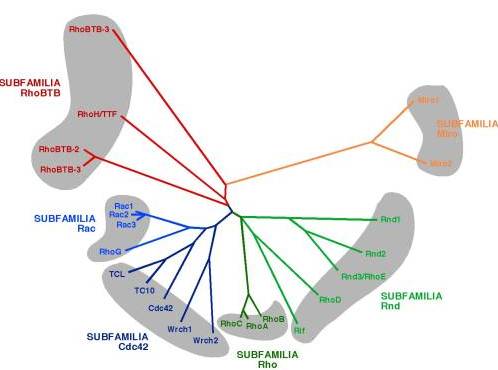 |
FIGURA 1. Subfamilias de las GTPasas Rho/Rac. Estas se clasifican en un dendograma de acuerdo con su grado de homología estructrural. Los miembros de cada subfamilia se agrupan en áreas sombreadas en color gris y con líneas y letras de un mismo color. En el caso de subfamilias muy emparentadas (v. gr., Rac y Cdc42 o Rho y Rnd), cada rama del árbol se señala con una gradación diferente de color. |
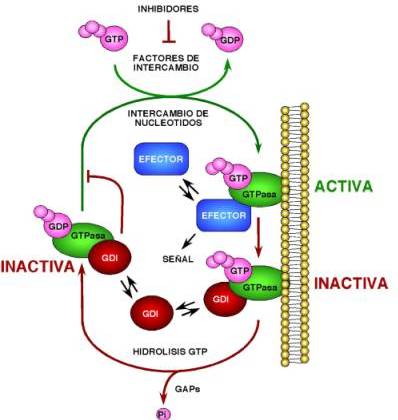 |
FIGURA 2. Ciclo de actividad de las GTPasas Rho/Rac. Ver detalles en el texto principal. |
FUNCIONES DE LAS GTPasas Rho/Rac
Regulación de la polimerización del citoesqueleto de actina . Desde un punto de vista histórico, el control de la polimerización del citoesqueleto de actina es la primera función atribuida a las GTPasas de la familia Rho/Rac. Así, se demostró inicialmente que la activación de RhoA induce la formación de fibras de estrés y adhesiones focales 15 . Por su parte, se demostró en paralelo que la forma activada de Rac promueve el ensamblaje de los filamentos de actina en la periferia celular para generar lamelipodios y ondulaciones de membrana 16 . Finalmente, se comprobó que la activación de Cdc42 provoca la aparición de filopodios, unas estructuras elongadas ricas en actina que se proyectan desde la membrana plasmática al medio circundante 17,18 ( Figura 3 ). Desde estos estudios iniciales, se ha visto que la regulación del citoesqueleto de actina por las GTPasas Rho/Rac es un proceso fundamental para poderse llevar a cabo otras funciones celulares como, por ejemplo, el establecimiento de la morfología y la polaridad celular o procesos de migración 10-14 .
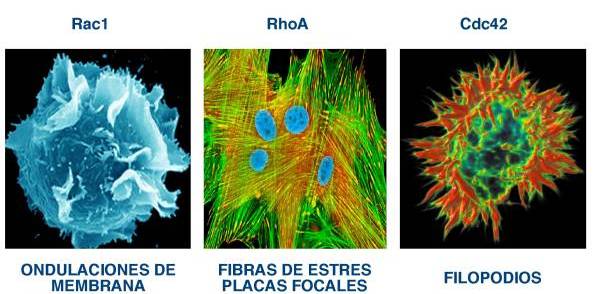 |
FIGURA 3. Ejemplos de los cambios citoesqueléticos inducidos por miembros de las subfamilia Rac, Rho y Cdc42. |
El establecimiento de la morfología y de la polaridad celular depende en gran medida de la presencia de señales extracelulares, que son captadas por la célula mediante receptores situados en la membrana plasmática. La transducción de estas señales a través de las rutas de señalización mediadas por las GTPasas Rho/Rac da lugar a modificaciones del citoesqueleto de actina que son fundamentales para estos procesos. Así, la actividad de Cdc42p es esencial en Saccharomyces cerevisiae para que la célula establezca correctamente el sitio de gemación y para que las protrusiones originadas durante el proceso de conjugación se orienten correctamente según un gradiente de feromonas 19-21 . En Caenorhabditis elegans , Cdc42 es esencial para establecer la polaridad del zigoto a través de sus efectores PAR y de la proteín cinasa atípica PKC-3 22,23 . El complejo PAR/PKC está conservado en eucariotas pluricelulares, participando en el establecimiento de la asimetría intracelular durante la maduración de los oocitos y la división de los neuroblastos en Drosophila melanogaster 24 . Las GTPasas Rho/Rac también intervienen en el desarrollo de la morfología y en el establecimiento de la polaridad de células epiteliales, regulando la formación de las uniones adherentes y de las uniones estrechas que determinan la orientación del eje apical-basolateral. RhoA, Rac1 y Cdc42 regulan la formación de uniones adherentes a través de su efecto sobre el citoesqueleto de actina 25,26 . Además, Cdc42 controla el ensamblaje de las uniones estrechas, probablemente a través de sus efectores PAR-3, PAR-6 y PKC atípica 27 . La formación de axones y dendritas en neuronas, que está dirigida en gran medida por la presencia de señales medioambientales, también está regulada por las GTPasas Rho/Rac a través de su efecto sobre la polimerización del citoesqueleto de actina 28-30 .
Las GTPasas Rho/Rac son también fundamentales para la migración celular , ya que proporcionan la fuerza motriz necesaria para este proceso a través de la regulación de la polimerización del citoesqueleto de actina ( Figura 4 ). La migración celular se inicia con el establecimiento de un lamelipodio en el frente de avance de la célula, junto con la aparición de nuevas adhesiones al sustrato extracelular. La GTPasa Rac1 es la responsable de la formación del lamelipodio a través de un doble efecto regulador sobre el citoesqueleto de actina: por una parte, estimula la polimerización de la actina a través de la activación del complejo Arp2/3 y del descaperuzamiento de los filamentos de actina situados en las proximidades de la membrana plasmática 31,32 ; por otro lado, reduce la tasa de despolimerización de la actina a través de la activación de la ruta PAK/LIMK, la cual inactiva a la proteína despolimerizadora de actina cofilina 33-35 . Junto a ello, Rac1 promueve la formación de complejos de adhesión de integrinas en el frente de avance, lo que favorece la acumulación de la forma activada de Rac1 en esta región 36 . Este fenómeno da lugar a un mecanismo de retroalimentación positiva que permite a las células seguir migrando aun cuando se esté produciendo un atenuamiento de la señalización a través de receptores de membrana 36 . Cdc42 promueve la polimerización de la actina para generar filopodios en el frente de avance de las células en migración 17 . El papel de los filopodios es estabilizar el movimiento direccional de la célula en respuesta a señales quimiotácticas, puesto que la eliminación de Cdc42 conlleva el paso de un movimiento direccional definido en otro aleatorio 37 . Por otra parte, la actividad de RhoA se requiere para el ensamblaje de adhesiones focales y para promover la contractilidad celular, lo que permite el movimiento del cuerpo celular y facilita que la parte posterior de la célula se despegue de la matriz 38 . La actividad de RhoA en el frente de avance de la célula es incompatible con la formación de protrusiones de la membrana, por lo cual debe ser inhibida. Este proceso es llevado a cabo por la forma activada de Rac1, que inhibe la función de RhoA en múltiples tipos celulares 39 . Las GTPasas Rho/Rac también juegan un papel esencial en la migración de grupos celulares, como la que se produce durante el cierre dorsal de Drosophila. En este caso, RhoA, a través de PKN y ROCK, controla el ensamblaje y la contracción de los filamentos de actina y miosina que conducen al cierre dorsal 40-43 . Rac1 y Cdc42 contribuyen al mismo a través de dos actividades: por un lado, la generación de filopodios y lamelipodios favorece el contacto de las dos láminas de células en migración, facilitando así el cierre 44-46 . Por otra parte, ambas GTPasas regulan la actividad de la cascada de JNK, que a su vez controla la transcripción de Dpp, un miembro de la familia del factor de crecimiento transformante b que regula el movimiento coordinado de la lámina epitelial 47 . Aunque la polimerización del citoesqueleto de actina es la función principal de las GTPasas Rho/Rac durante el proceso de migración celular, también contribuyen al mismo por medio de otras actividades, como la regulación de la polarización del citoesqueleto de microtúbulos 12 .
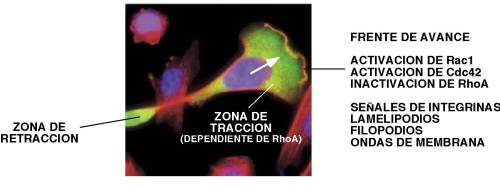 |
FIGURA 4. Migración celular. La figura muestra una célula en movimiento direccional (en la dirección indicada por la flecha) y las diferentes zonas celulares implicadas (frente de avance, zona de tracción, y zona de retracción). En la imagen se obserban otras células (rojo) que no están en movimiento. Los núcleos se muestran en violeta. El citosol de la célula en movimiento, en color verde. Ver detalles en el texto principal. |
Control de la proliferación celular . Las GTPasas Rho/Rac participan en diversas etapas y procesos del ciclo celular. RhoA, Rac1 y Cdc42 median procesos mitogénicos, promoviendo el avance de las células estimuladas a través de la fase G1 del ciclo celular 48-51 mediante la inducción de la ciclina D1 y la represión de la expresión del regulador negativo p21 52-54 . Cdc42 interviene también en el establecimiento de la orientación del huso mitótico y estabiliza su unión al cinetocoro a través de la activación de su efector mDia3. De esta manera se asegura que el alineamiento de los cromosomas en la placa metafásica 55 . Finalmente, se ha descrito que las GTPasas RhoA y RhoD tienen un papel fundamental durante el proceso de citoquinesis 56-59 . En el caso de RhoA, este proceso está mediado por tres proteínas efectoras: la cinasa ROCK 60,61 , la cinasa citrón 62 y la proteína mDia1 63,64 . ROCK fosforila y activa la cadena ligera de la miosina-II (MLC-II), directamente y/o mediante la inhibición de la MLC fosfatasa 65,66 . Citrón también fosforila la MLC-II 67 , mientras que mDia1 promueve la nucleación y polimerización de la actina en la hendidura mitótica 64,68,69 . Como consecuencia del concurso de estos efectores, se produce un incremento en la contractilidad del esqueleto de actomiosina en la hendidura mitótica mediada por MLC-II, lo que conduce a la separación de las células hijas.
Regulación de la transcripción . La sobreexpresión de las formas activadas de RhoA, Rac1 y Cdc42 da lugar a la activación de la cascada de cinasas que conduce a la activación de JNK 70 , regulando la actividad del factor transcripcional c-Jun de forma específica en función del tipo celular analizado 70 . Estas GTPasas también regulan la transcripción mediada por los factores SRF 71 , NF- k B 72,73 , c-Myc 74 . Esta lista se amplía continuamente, dando lugar a un número cada vez mayor de factores de transcripción implicados en la ruta Rho/Rac ( Figura 5 ). Los patrones globales de expresión génica inducidos por las formas activadas de las GTPasas RhoA, Rac1 y Cdc42 han sido analizados recientemente mediante el uso de microarrays 75 . Estos estudios han mostrado que tanto Rac1 Q61L como Cdc42 Q61L regulan positivamente la transcripción de genes que codifican para proteínas de adhesión celular y componentes de la matriz extracelular. En cambio, RhoA Q63L incrementa la transcripción de genes relacionados con el ciclo celular y de factores promotores del crecimiento que, en algunos casos, son inhibidos por Rac1 Q61L y Cdc42 Q61L . Los cambios inducidos en el transcriptoma por la expresión de estas GTPasas probablemente tengan significación biológica, puesto que presentan una buena correlación con las funciones descritas previamente para estas proteínas.
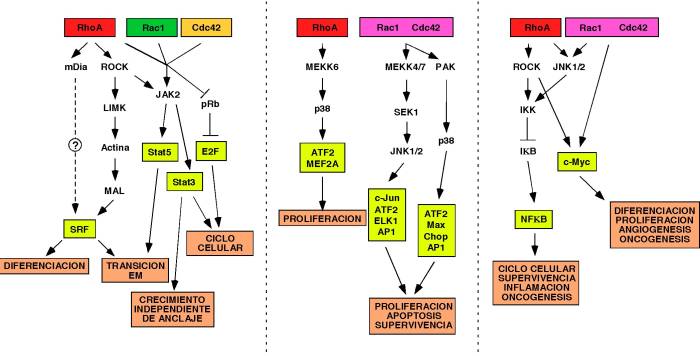 |
FIGURA 5. Esquema de la activación o represión de factores transcripcionales por parte de las GTPasas Rac1, RhoA y Cdc42. Los factores transcripcionales se enmarcan en cajas amarillas. Las respuestas derivadas de la activación de los mismos se muestran enmarcados en cajas castañas. Se indican también las rutas de señalización implicadas en la activación de dichos factores transcripcionales. Las rutas mal definidas se indican con flechas discontinuas. |
Endocitosis y procesos relacionados. Las GTPasas Rho/Rac también participan en mecanismos endocíticos . Por ejemplo, Rac1 y Cdc42 estimulan la formación de vesículas macropinocíticas 76,77 . Las GTPasas Rho/Rac se han implicado también en la regulación del tráfico endocítico mediado por la ruta de clatrina 78-80 . En este sentido, se ha demonstrado que RhoD participa en el tráfico intracelular de endosomas tempranos a través de la activación secuencial de una isoforma del efector Dia y de la cinasa Src 81 , mientras que RhoB controla la transferencia del contenido de cuerpos multivesiculares a lisosomas para su degradación 82 . Finalmente, nuestro laboratorio ha demostrado recientemente que RhoG participa en la internalización de vesículas caveosomales (Prieto-Sánchez et al., en prensa).
La internalización de partículas mediante fagocitosis también requiere la activación de las GTPasas Rho/Rac y los subsiguientes cambios citoesqueléticos promovidos por éstas 83,84 . En la fagocitosis de tipo I, la activación localizada de Cdc42 da lugar a la formación de filopodios alrededor de la partícula a fagocitar, y la activación subsiguiente de Rac1 promueve la internalización de la misma. RhoA no parece intervenir en este proceso, pero sí en la fagocitosis de tipo II, dando lugar a la formación de adhesiones focales que facilitan el contacto del fagocito con la partícula 85 .
Otras funciones . Además de su papel en los procesos anteriores, algunos miembros de la familia Rho/Rac poseen funciones reguladoras específicas. Rac1 y 2 son activadoras del complejo de la NADPH oxidasa en células fagocíticas, promoviendo la generación de radicales libres de oxígeno que actúan como mecanismo de defensa frente a microorganismos 86-88 . Recientemente se ha descrito que Rac1 también posee esta función en células no fagocíticas. Así, la regulación de las isoformas vasculares de la NADPH oxidasa por Rac1 se ha relacionado con múltiples procesos como hipertrofia cardiaca y vascular, hipertensión, migración leucocitaria y aterosclerosis 89 .
El amplio espectro de funciones biológicas reguladas por la familia Rho/Rac explica que la aparición de mutaciones en los genes codificantes para estas GTPasas, así como en sus reguladores y efectores, cause la aparición de diversas patologías. Un caso frecuente es la correlación entre alteraciones en la ruta de las GTPasas Rho/Rac y la génesis de diversas enfermedades neurológicas 28 . Así es el caso del retraso mental no sindrómico asociado al cromosoma X , donde se han descrito mutaciones en la oligofrenina-1 (una proteína GAP para RhoA, Rac1 y Cdc42) 90 , PAK-3 (una cinasa efectora de Rac1 y Cdc42) 91 y ARHGEF-6 92 . Asimismo, se han descrito mutaciones de proteínas relacionadas con las GTPasas Rho/Rac en otro tipo de patologías, como la displasia faciogenital (originada por una mutación que trunca FGD1, un GEF para Cdc42); síndrome de Wiskott-Aldrich , trombocitopenia y neutropenia congénita asociada al cromosoma X (todas ellas causadas por mutaciones en WASP, un efector de Cdc42); sordera no sindrómica (originada por mutaciones en Diaphanous I, un efector de RhoA) y enfermedad de Tangier (donde se ha observado un incremento en los niveles de expresión de RhoA, RhoB, RhoG y Rac1) 93 . La aparición de una mutación en el gen rac2 que produce una proteína mutante con efecto inhibitorio dominante (Asp 57 ® Asn) se ha relacionado con una inmunodeficiencia neutrofílica 94 .
Muchos GEFs que activan a las GTPasas Rho/Rac (Dbl, Lfc, Lbc, Vav1), fueron aislados inicialmente como oncogenes en ensayos de transformación de fibroblastos murinos con ADN derivado de tumores humanos 95 . Se ha comprobado que las formas constitutivamente activadas de RhoA, Rac1 y Cdc42 también inducen transformación celular y metástasis , aunque no se conocen con exactitud los efectores responsables de este proceso 96,97 . Pese a ello, no se ha descrito la presencia de formas constitutivamente activadas de las GTPasas Rho/Rac en tumores, aunque algunas de ellas se han encontrado sobreexpresadas en distintos tipos de cánceres 98-100 . En algunos casos, la sobreexpresión se correlaciona con la evolución clínica de los pacientes, por lo que existe la posibilidad de que estas proteínas puedan ser utilizadas como marcadores pronósticos 100 . RhoC, por ejemplo, se encuentra sobreexpresada en estadíos invasivos de distintos tipos de tumores como carcinomas gástricos, adenocarcinomas ductales de páncreas, carcinomas hepatocelulares, cánceres de pulmón de células no pequeñas y cánceres de mama de tipo inflamatorio. Además, se ha confirmado que RhoC es un promotor de metástasis mediante técnicas de barrido genómico 100 . Otro ejemplo de este tipo es Rac1b, que se genera por procesamiento alternativo del gen rac1 y se encuentra sobreexpresada en tumores de colon y de mama 101 .
Hasta ahora, sólo se han encontrado alteraciones genéticas en una GTPasa de la familia Rho/Rac (RhoH/TTF) en tumores primarios. Las alteraciones en este gen incluyen reordenamientos (en mieloma múltiple y linfoma no Hodgkin) o mutaciones puntuales en la región 5´ no codificante que afectan a los niveles de expresión de la proteína (en linfomas B) 100 . Se especula que la falta de detección de formas constitutivamente activadas de las GTPasas Rho/Rac en tumores podría deberse a que estas proteínas necesitan ciclar entre su estados inactivo y activo para llevar a cabo correctamente las funciones biológicas en las que están implicadas. Experimentos realizados en Drosophila melanogaster avalan esta hipótesis, puesto que en este sistema biológico la expresión tanto de la forma constitutivamente activa de Rac1 como de la forma dominante negativa produce el mismo efecto fenotípico.
Aunque también minoritarias, se han encontrado alteraciones en los genes que codifican GEFs para proteínas Rho/Rac en algunas muestras de tumores (LARG y TIAM-1) 102,103 . Más recientemente, se ha demostrado que la sobreexpresión del GEF Vav1 en tumores de páncreas y leucemias juega un papel importante en este tipo de cánceres 104 (Prieto-Sánchez et al., sometido). Esta sobreexpresión parece debido más a cambios epigenéticos (cambios en la metilación del gen) que a procesos de mutación del locus de vav1 104 . Pese a esta baja frecuencia de mutaciones, la evidencia disponible actualmente indica que los niveles normales de proteínas GEF sí son cruciales para que puedan producirse procesos de progresión tumoral. Así, se ha visto que la deleción del gen tiam-1 en ratones hace que estos originen menos tumores, tanto en piel como en colon 105,106 . Es probable que la relación entre rutas de Rho/Rac y tumorigénesis se amplie más en el futuro cuando otras cepas de ratones carentes de elementos de señalización de dichas rutas se analicen en modelos experimentales de tumorigénesis in vivo.
Debido a su carácter inhibitorio, siempre se ha especulado que las proteínas GAP para las GTPasas Rho/Rac podrían actuar como supresores tumorales . Aunque todavía la evidencia experimental en este sentido es escasa, existen datos que señalan el posible papel inhibidor de tumores de la p190GAP y las quimerinas en gliomas y carcinomas mamarios, respectivamente 107-109 . Como en el caso de los GEF, es probable que el análisis de ratones knockout deficientes para las múltiples GAP existentes den luz sobre si tal papel es real en el futuro.
Más recientemente, se ha visto que la desregulación de las rutas Rho/Rac pueden dar lugar a pérdida de la homeostasis cardiovascular. Por ejemplo, nuestro grupo ha encontrado recientemente que los ratones deficientes en los GEF Vav3 o Vav2 sufren una enfermedad cardiovascular severa que es muy reminiscente de la hipertensión esencial de humanos. En el caso de Vav3, esto se debe a un mal funcionamiento de neuronas inhibitorias GABaérgicas de la médula ventrolateral, lo que conlleva un aumento de la actividad simpática en estos animales (Sauzeau et al., artículo sometido a revisión actualmente). En el caso de Vav2, los problemas cardiovasculares se originan por alteraciones en el citoesqueleto de las células de músculo liso vasculares, las cuales no vasodilatan bien tras estimulación con óxido nítrico (Sauzeau y Bustelo, resultados no publicados).
Por otro lado, algunas bacterias patógenas se han dado cuenta de los beneficios potenciales que, para el propio patógeno, posee la activación espuria de las rutas Rho/Rac. Eso ha determinado que se hayan desarrollado durante su proceso evolutivo diversos factores de virulencia que modifican el ciclo de activación y desactivación de las GTPasas Rho/Rac 110 . Así, se ha demostrado recientemente que la enterobacteria Salmonella spp. posee dos proteínas estructuralmente muy relacionadas (SopE y SopE2) que se comportan como GEFs para Rac1 y Cdc42. La activación de estas GTPasas origina cambios en el citoesqueleto de actina que facilitan la internalización de la bacteria en las células epiteliales del intestino. Una vez en el interior de la célula hospedadora, Salmonella contribuye a la vuelta al estado basal del citoesqueleto liberando SptP, una proteína GAP para Rac1 y Cdc42 que facilita el cese de la señalización inducida por éstas. De esta manera, el patógeno evita los daños potenciales que podría producir a su célula hospedadora una señalización exacerbada mediada por las GTPasas Rho/Rac 110 . De forma análoga, Yersinia spp. y Pseudomonas aeruginosa también poseen proteínas que actúan como GAPs para las GTPasas Rho/Rac (YopE y ExoS, respectivamente) 110 .
Otras bacterias patógenas han desarrollado toxinas capaces de modificar directamente a las GTPasas Rho/Rac, lo que contribuye a la activación o inactivación de éstas 111 . La exoenzima C3 de Clostridium botulinum , así como otras exoenzimas con actividad transferasa sintetizadas por Costridium limosum, Bacillus cereus y Staphylococcus aureus, inducen la ADP-ribosilación de RhoA, RhoB y RhoC. Este proceso no afecta a la unión de RhoA a sus efectores ni a la actividad GAP, pero impide la interacción con los GEFs y bloquea la disociación de los GDIs. De esta manera, la GTPasa se acumula en el citosol en su forma inactiva, lo que impide su interacción con las proteínas efectoras. Toxinas producidas por Clostridium spp. dan lugar a la glucosilación de residuos situados en el switch I de las GTPasas Rho/Rac 111 . Esta modificación impide la interacción de las GTPasas con sus efectores, bloquea la actividad GTPasa tanto intrínseca como inducida por GAPs, e inhibe el intercambio de nucleótidos producido por los GEFs. Además, la glucosilación impide la interacción de las GTPasas con los GDIs, manteniéndolas permanentemente unidas a la membrana plasmática e impidiendo la translocación de las GTPasas no modificadas presentes en la misma célula. Este bloqueo del ciclaje entre el citosol y la membrana provoca que las GTPasas glucosiladas se comporten como dominantes negativos. Los factores CNF1 y CNF2, producidos por formas enteropatogénicas de Escherichia coli, y la toxina DNT, sintetizada por Bordetella spp. , poseen respectivamente actividad desamidasa y desamidasa/transglutaminasa sobre el residuo Gln 63 de RhoA. Esta modificación bloquea la actividad GTPasa de RhoA, tanto intrínseca como inducida por GAPs, dando lugar a su activación constitutiva 111 .
Las GTPasas de la familia Rho/Rac también son utilizadas durante el proceso infectivo o de latencia de diversos virus . Quizá el caso más llamativo en este sentido sea v-Nef, una proteína codificada por el virus de la inmunodeficiencia adquirida que es esencial para mantener niveles altos de viremia y para la progresión de la enfermedad en la célula hospedadora. v-Nef interacciona con diversos elementos pertenecientes a la ruta de señalización de las GTPasas Rho/Rac, uniéndose y activando a los GEFs de la familia Vav y al efector de Rac1 PAK 112 . La interacción simultánea de v-Nef con las proteínas Vav y PAK favorece la activación de ésta cinasa mediante Rac1, el sustrato de Vav que es arrastrado hacia la proximidad de PAK via su interacción con el dominio catalítico de dicho GEF 112 . La activación de PAK provoca, a su vez, cambios citoesqueléticos y la estimulación de la cinasa JNK, lo que favorece tanto la producción como la infectividad del virus. Finalmente, se ha demonstrado recientemente por nuestro laboratorio que miembros de la familia herpesvirus- g utilizan también a Vav1, Vav2 y Rac1 para favorecer el establecimiento de su estado latente en las células B hospedadoras (Rodrigues et al., resultados no publicados). En este caso, los virus codifican una molécula adaptadora (M2) que, a través de la formación de un complejo trimérico con tirosín cinasas de la familia Src, favorece la activación de los GEFs Vav por fosforilación en tirosina.
Es de destacar que todos los avances indicados en este trabajo se han realizado durante los últimos diez años, lo que ha permitido pasar del mero listado de GTPasas sin función conocida a un conocimiento cada vez más profundo de sus funciones biológicas, regulación, características estructurales, rutas de señalizacion y participación en patologías. Estos avances servirán, en el futuro próximo, como trampolín con el que tomar nuevo impulso para lograr un conocimiento cada vez más holístico de estos cruciales reguladores intracelulares. Dado que muchas de las proteínas participantes poseen propiedades catalíticas bien definidas y diferentes de otros elementos de señalización, es de esperar que de dichos avances se deriven a su vez nuevas vías terapeúticas con las que prevenir o tratar las alteraciones de señalización que están detrás de la génesis y/o progresión de patologías con alta indicencia en humanos.
El trabajo de los autores de este artículo está financiado por proyectos del National Cancer Institute/National Institutes of Health de los EE.UU. (5RO1-CA73735-09), del Programa Nacional de Biomedicina del Ministerio de Educación y Ciencia (SAF2003-00028), del Fondo de Investigaciones Sanitarias del Instituto Carlos III (Ministerio de Sanidad y Consumo; PI020103), de la Junta de Castilla-León (SA053A05) y de la Fundación Ramón Areces. R.M.P-S. ha sido becada por Ministerio de Educación y Ciencia (FPU AP2000-3829).
1. Bustelo, X. R. Understanding Rho/Rac biology in T-cells using animal models. Bioessays 24 , 602-12 (2002).
2. Bustelo, X. R. Knocked out by Rho/Rac T-cell biology. Histol Histopathol 17 , 871-5 (2002).
3. DerMardirossian, C. & Bokoch, G. M. GDIs: central regulatory molecules in Rho GTPase activation. Trends Cell Biol 15 , 356-63 (2005).
4. Olofsson, B. Rho guanine dissociation inhibitors: pivotal molecules in cellular signalling. Cell Signal 11 , 545-54 (1999).
5. Sasaki, T. & Takai, Y. The Rho small G protein family-Rho GDI system as a temporal and spatial determinant for cytoskeletal control. Biochem Biophys Res Commun 245 , 641-5 (1998).
6. Vincent, S., Jeanteur, P. & Fort, P. Growth-regulated expression of rhoG, a new member of the ras homolog gene family. Mol Cell Biol 12 , 3138-48 (1992).
7. Fritz, G., Gnad, R. & Kaina, B. Cell and tissue-type specific expression of Ras-related GTPase RhoB. Anticancer Res 19 , 1681-8 (1999).
8. Tu, S. & Cerione, R. A. Cdc42 is a substrate for caspases and influences Fas-induced apoptosis. J Biol Chem 276 , 19656-63 (2001).
9. Wang, H. R. et al. Regulation of cell polarity and protrusion formation by targeting RhoA for degradation. Science 302 , 1775-9 (2003).
10. Van Aelst, L. & D'Souza-Schorey, C. Rho GTPases and signaling networks. Genes Dev 11 , 2295-322 (1997).
11. Kaibuchi, K., Kuroda, S. & Amano, M. Regulation of the cytoskeleton and cell adhesion by the Rho family GTPases in mammalian cells. Annu Rev Biochem 68 , 459-86 (1999).
12. Etienne-Manneville, S. & Hall, A. Rho GTPases in cell biology. Nature 420 , 629-35 (2002).
13. Bar-Sagi, D. & Hall, A. Ras and Rho GTPases: a family reunion. Cell 103 , 227-38 (2000).
14. Mackay, D. J. & Hall, A. Rho GTPases. J Biol Chem 273 , 20685-8 (1998).
15. Ridley, A. J. & Hall, A. The small GTP-binding protein rho regulates the assembly of focal adhesions and actin stress fibers in response to growth factors. Cell 70 , 389-99 (1992).
16. Ridley, A. J., Paterson, H. F., Johnston, C. L., Diekmann, D. & Hall, A. The small GTP-binding protein rac regulates growth factor-induced membrane ruffling. Cell 70 , 401-10 (1992).
17. Nobes, C. D. & Hall, A. Rho, rac, and cdc42 GTPases regulate the assembly of multimolecular focal complexes associated with actin stress fibers, lamellipodia, and filopodia. Cell 81 , 53-62 (1995).
18. Kozma, R., Ahmed, S., Best, A. & Lim, L. The Ras-related protein Cdc42Hs and bradykinin promote formation of peripheral actin microspikes and filopodia in Swiss 3T3 fibroblasts. Mol Cell Biol 15 , 1942-52 (1995).
19. Pruyne, D. & Bretscher, A. Polarization of cell growth in yeast. J Cell Sci 113 ( Pt 4) , 571-85 (2000).
20. Pruyne, D. & Bretscher, A. Polarization of cell growth in yeast. I. Establishment and maintenance of polarity states. J Cell Sci 113 ( Pt 3) , 365-75 (2000).
21. Pruyne, D., Legesse-Miller, A., Gao, L., Dong, Y. & Bretscher, A. Mechanisms of polarized growth and organelle segregation in yeast. Annu Rev Cell Dev Biol 20 , 559-91 (2004).
22. Kemphues, K. PARsing embryonic polarity. Cell 101 , 345-8 (2000).
23. Cuenca, A. A., Schetter, A., Aceto, D., Kemphues, K. & Seydoux, G. Polarization of the C. elegans zygote proceeds via distinct establishment and maintenance phases. Development 130 , 1255-65 (2003).
24. Noda, Y. et al. Human homologues of the Caenorhabditis elegans cell polarity protein PAR6 as an adaptor that links the small GTPases Rac and Cdc42 to atypical protein kinase C. Genes Cells 6 , 107-19 (2001).
25. Vasioukhin, V., Bauer, C., Yin, M. & Fuchs, E. Directed actin polymerization is the driving force for epithelial cell-cell adhesion. Cell 100 , 209-19 (2000).
26. Raich, W. B., Agbunag, C. & Hardin, J. Rapid epithelial-sheet sealing in the Caenorhabditis elegans embryo requires cadherin-dependent filopodial priming. Curr Biol 9 , 1139-46 (1999).
27. Yamanaka, T. et al. PAR-6 regulates aPKC activity in a novel way and mediates cell-cell contact-induced formation of the epithelial junctional complex. Genes Cells 6 , 721-31 (2001).
28. Luo, L. Rho GTPases in neuronal morphogenesis. Nat Rev Neurosci 1 , 173-80 (2000).
29. Lee, T., Winter, C., Marticke, S. S., Lee, A. & Luo, L. Essential roles of Drosophila RhoA in the regulation of neuroblast proliferation and dendritic but not axonal morphogenesis. Neuron 25 , 307-16 (2000).
30. Ozdinler, P. H. & Erzurumlu, R. S. Regulation of neurotrophin-induced axonal responses via Rho GTPases. J Comp Neurol 438 , 377-87 (2001).
31. Miki, H., Yamaguchi, H., Suetsugu, S. & Takenawa, T. IRSp53 is an essential intermediate between Rac and WAVE in the regulation of membrane ruffling. Nature 408 , 732-5 (2000).
32. Tolias, K. F. et al. Type Ialpha phosphatidylinositol-4-phosphate 5-kinase mediates Rac-dependent actin assembly. Curr Biol 10 , 153-6 (2000).
33. Stanyon, C. A. & Bernard, O. LIM-kinase1. Int J Biochem Cell Biol 31 , 389-94 (1999).
34. Chan, A. Y., Bailly, M., Zebda, N., Segall, J. E. & Condeelis, J. S. Role of cofilin in epidermal growth factor-stimulated actin polymerization and lamellipod protrusion. J Cell Biol 148 , 531-42 (2000).
35. Zebda, N. et al. Phosphorylation of ADF/cofilin abolishes EGF-induced actin nucleation at the leading edge and subsequent lamellipod extension. J Cell Biol 151 , 1119-28 (2000).
36. Kiosses, W. B., Shattil, S. J., Pampori, N. & Schwartz, M. A. Rac recruits high-affinity integrin alphavbeta3 to lamellipodia in endothelial cell migration. Nat Cell Biol 3 , 316-20 (2001).
37. Allen, W. E., Zicha, D., Ridley, A. J. & Jones, G. E. A role for Cdc42 in macrophage chemotaxis. J Cell Biol 141 , 1147-57 (1998).
38. Mitchison, T. J. & Cramer, L. P. Actin-based cell motility and cell locomotion. Cell 84 , 371-9 (1996).
39. Sander, E. E., ten Klooster, J. P., van Delft, S., van der Kammen, R. A. & Collard, J. G. Rac downregulates Rho activity: reciprocal balance between both GTPases determines cellular morphology and migratory behavior. J Cell Biol 147 , 1009-22 (1999).
40. Lu, Y. & Settleman, J. The Drosophila Pkn protein kinase is a Rho/Rac effector target required for dorsal closure during embryogenesis. Genes Dev 13 , 1168-80 (1999).
41. Lu, Y. & Settleman, J. The role of rho family GTPases in development: lessons from Drosophila melanogaster. Mol Cell Biol Res Commun 1 , 87-94 (1999).
42. Harden, N. Signaling pathways directing the movement and fusion of epithelial sheets: lessons from dorsal closure in Drosophila. Differentiation 70 , 181-203 (2002).
43. Harden, N., Loh, H. Y., Chia, W. & Lim, L. A dominant inhibitory version of the small GTP-binding protein Rac disrupts cytoskeletal structures and inhibits developmental cell shape changes in Drosophila. Development 121 , 903-14 (1995).
44. Jacinto, A. et al. Dynamic actin-based epithelial adhesion and cell matching during Drosophila dorsal closure. Curr Biol 10 , 1420-6 (2000).
45. Jacinto, A. & Martin, P. Morphogenesis: unravelling the cell biology of hole closure. Curr Biol 11 , R705-7 (2001).
46. Jacinto, A. et al. Dynamic analysis of actin cable function during Drosophila dorsal closure. Curr Biol 12 , 1245-50 (2002).
47. Glise, B. & Noselli, S. Coupling of Jun amino-terminal kinase and Decapentaplegic signaling pathways in Drosophila morphogenesis. Genes Dev 11 , 1738-47 (1997).
48. Olson, M. F., Ashworth, A. & Hall, A. An essential role for Rho, Rac, and Cdc42 GTPases in cell cycle progression through G1. Science 269 , 1270-2 (1995).
49. Urich, M., Senften, M., Shaw, P. E. & Ballmer-Hofer, K. A role for the small GTPase Rac in polyomavirus middle-T antigen-mediated activation of the serum response element and in cell transformation. Oncogene 14 , 1235-41 (1997).
50. Gjoerup, O., Lukas, J., Bartek, J. & Willumsen, B. M. Rac and Cdc42 are potent stimulators of E2F-dependent transcription capable of promoting retinoblastoma susceptibility gene product hyperphosphorylation. J Biol Chem 273 , 18812-8 (1998).
51. Roovers, K. & Assoian, R. K. Effects of rho kinase and actin stress fibers on sustained extracellular signal-regulated kinase activity and activation of G(1) phase cyclin-dependent kinases. Mol Cell Biol 23 , 4283-94 (2003).
52. Olson, M. F., Paterson, H. F. & Marshall, C. J. Signals from Ras and Rho GTPases interact to regulate expression of p21Waf1/Cip1. Nature 394 , 295-9 (1998).
53. Coleman, M. L., Marshall, C. J. & Olson, M. F. Ras promotes p21(Waf1/Cip1) protein stability via a cyclin D1-imposed block in proteasome-mediated degradation. Embo J 22 , 2036-46 (2003).
54. Coleman, M. L., Marshall, C. J. & Olson, M. F. RAS and RHO GTPases in G1-phase cell-cycle regulation. Nat Rev Mol Cell Biol 5 , 355-66 (2004).
55. Yasuda, S. et al. Cdc42 and mDia3 regulate microtubule attachment to kinetochores. Nature 428 , 767-71 (2004).
56. Takaishi, K., Sasaki, T., Kameyama, T., Tsukita, S. & Takai, Y. Translocation of activated Rho from the cytoplasm to membrane ruffling area, cell-cell adhesion sites and cleavage furrows. Oncogene 11 , 39-48 (1995).
57. Tsubakimoto, K. et al. Small GTPase RhoD suppresses cell migration and cytokinesis. Oncogene 18 , 2431-40 (1999).
58. Kimura, K., Tsuji, T., Takada, Y., Miki, T. & Narumiya, S. Accumulation of GTP-bound RhoA during cytokinesis and a critical role of ECT2 in this accumulation. J Biol Chem 275 , 17233-6 (2000).
59. Yoshizaki, H. et al. Activity of Rho-family GTPases during cell division as visualized with FRET-based probes. J Cell Biol 162 , 223-32 (2003).
60. Yasui, Y. et al. Roles of Rho-associated kinase in cytokinesis; mutations in Rho-associated kinase phosphorylation sites impair cytokinetic segregation of glial filaments. J Cell Biol 143 , 1249-58 (1998).
61. Kosako, H. et al. Rho-kinase/ROCK is involved in cytokinesis through the phosphorylation of myosin light chain and not ezrin/radixin/moesin proteins at the cleavage furrow. Oncogene 19 , 6059-64 (2000).
62. Madaule, P. et al. Role of citron kinase as a target of the small GTPase Rho in cytokinesis. Nature 394 , 491-4 (1998).
63. Castrillon, D. H. & Wasserman, S. A. Diaphanous is required for cytokinesis in Drosophila and shares domains of similarity with the products of the limb deformity gene. Development 120 , 3367-77 (1994).
64. Watanabe, N. et al. p140mDia, a mammalian homolog of Drosophila diaphanous, is a target protein for Rho small GTPase and is a ligand for profilin. Embo J 16 , 3044-56 (1997).
65. Amano, M. et al. Phosphorylation and activation of myosin by Rho-associated kinase (Rho-kinase). J Biol Chem 271 , 20246-9 (1996).
66. Kosako, H. et al. Specific accumulation of Rho-associated kinase at the cleavage furrow during cytokinesis: cleavage furrow-specific phosphorylation of intermediate filaments. Oncogene 18 , 2783-8 (1999).
67. Yamashiro, S. et al. Citron kinase, a Rho-dependent kinase, induces di-phosphorylation of regulatory light chain of myosin II. Mol Biol Cell 14 , 1745-56 (2003).
68. Li, F. & Higgs, H. N. The mouse Formin mDia1 is a potent actin nucleation factor regulated by autoinhibition. Curr Biol 13 , 1335-40 (2003).
69. Watanabe, N. & Higashida, C. Formins: processive cappers of growing actin filaments. Exp Cell Res 301 , 16-22 (2004).
70. Coso, O. A. et al. The small GTP-binding proteins Rac1 and Cdc42 regulate the activity of the JNK/SAPK signaling pathway. Cell 81 , 1137-46 (1995).
71. Hill, C. S., Wynne, J. & Treisman, R. The Rho family GTPases RhoA, Rac1, and CDC42Hs regulate transcriptional activation by SRF. Cell 81 , 1159-70 (1995).
72. Perona, R. et al. Activation of the nuclear factor-kappaB by Rho, CDC42, and Rac-1 proteins. Genes Dev 11 , 463-75 (1997).
73. Montaner, S., Perona, R., Saniger, L. & Lacal, J. C. Multiple signalling pathways lead to the activation of the nuclear factor kappaB by the Rho family of GTPases. J Biol Chem 273 , 12779-85 (1998).
74. Chiariello, M., Marinissen, M. J. & Gutkind, J. S. Regulation of c-myc expression by PDGF through Rho GTPases. Nat Cell Biol 3 , 580-6 (2001).
75. Teramoto, H. et al. Identification of H-Ras, RhoA, Rac1 and Cdc42 responsive genes. Oncogene 22 , 2689-97 (2003).
76. West, M. A., Prescott, A. R., Eskelinen, E. L., Ridley, A. J. & Watts, C. Rac is required for constitutive macropinocytosis by dendritic cells but does not control its downregulation. Curr Biol 10 , 839-48 (2000).
77. Dharmawardhane, S. et al. Regulation of macropinocytosis by p21-activated kinase-1. Mol Biol Cell 11 , 3341-52 (2000).
78. Ridley, A. J. Rho proteins: linking signaling with membrane trafficking. Traffic 2 , 303-10 (2001).
79. Symons, M. & Rusk, N. Control of vesicular trafficking by Rho GTPases. Curr Biol 13 , R409-18 (2003).
80. Ellis, S. & Mellor, H. Regulation of endocytic traffic by rho family GTPases. Trends Cell Biol 10 , 85-8 (2000).
81. Gasman, S., Kalaidzidis, Y. & Zerial, M. RhoD regulates endosome dynamics through Diaphanous-related Formin and Src tyrosine kinase. Nat Cell Biol 5 , 195-204 (2003).
82. Gampel, A., Parker, P. J. & Mellor, H. Regulation of epidermal growth factor receptor traffic by the small GTPase rhoB. Curr Biol 9 , 955-8 (1999).
83. Cox, D. et al. Requirements for both Rac1 and Cdc42 in membrane ruffling and phagocytosis in leukocytes. J Exp Med 186 , 1487-94 (1997).
84. Massol, P., Montcourrier, P., Guillemot, J. C. & Chavrier, P. Fc receptor-mediated phagocytosis requires CDC42 and Rac1. Embo J 17 , 6219-29 (1998).
85. Caron, E. & Hall, A. Identification of two distinct mechanisms of phagocytosis controlled by different Rho GTPases. Science 282 , 1717-21 (1998).
86. Kwong, C. H., Malech, H. L., Rotrosen, D. & Leto, T. L. Regulation of the human neutrophil NADPH oxidase by rho-related G-proteins. Biochemistry 32 , 5711-7 (1993).
87. Dorseuil, O. et al. Inhibition of superoxide production in B lymphocytes by rac antisense oligonucleotides. J Biol Chem 267 , 20540-2 (1992).
88. Joneson, T. & Bar-Sagi, D. A Rac1 effector site controlling mitogenesis through superoxide production. J Biol Chem 273 , 17991-4 (1998).
89. Bokoch, G. M. & Knaus, U. G. NADPH oxidases: not just for leukocytes anymore! Trends Biochem Sci 28 , 502-8 (2003).
90. Billuart, P. et al. Oligophrenin 1 encodes a rho-GAP protein involved in X-linked mental retardation. Pathol Biol (Paris) 46 , 678 (1998).
91. Allen, K. M. et al. PAK3 mutation in nonsyndromic X-linked mental retardation. Nat Genet 20 , 25-30 (1998).
92. Kutsche, K. et al. Mutations in ARHGEF6, encoding a guanine nucleotide exchange factor for Rho GTPases, in patients with X-linked mental retardation. Nat Genet 26 , 247-50 (2000).
93. Boettner, B. & Van Aelst, L. The role of Rho GTPases in disease development. Gene 286 , 155-74 (2002).
94. Williams, D. A. et al. Dominant negative mutation of the hematopoietic-specific Rho GTPase, Rac2, is associated with a human phagocyte immunodeficiency. Blood 96 , 1646-54 (2000).
95. Hoffman, G. R. & Cerione, R. A. Signaling to the Rho GTPases: networking with the DH domain. FEBS Lett 513 , 85-91 (2002).
96. Perona, R. et al. Tumorigenic activity of rho genes from Aplysia californica. Oncogene 8 , 1285-92 (1993).
97. del Peso, L. et al. Rho proteins induce metastatic properties in vivo. Oncogene 15 , 3047-57 (1997).
98. Gomez del Pulgar, T., Benitah, S. A., Valeron, P. F., Espina, C. & Lacal, J. C. Rho GTPase expression in tumourigenesis: evidence for a significant link. Bioessays 27 , 602-13 (2005).
99. Benitah, S. A., Valeron, P. F., van Aelst, L., Marshall, C. J. & Lacal, J. C. Rho GTPases in human cancer: an unresolved link to upstream and downstream transcriptional regulation. Biochim Biophys Acta 1705 , 121-32 (2004).
100. Sahai, E. & Marshall, C. J. RHO-GTPases and cancer. Nat Rev Cancer 2 , 133-42 (2002).
101. Jordan, P., Brazao, R., Boavida, M. G., Gespach, C. & Chastre, E. Cloning of a novel human Rac1b splice variant with increased expression in colorectal tumors. Oncogene 18 , 6835-9 (1999).
102. Kourlas, P. J. et al. Identification of a gene at 11q23 encoding a guanine nucleotide exchange factor: evidence for its fusion with MLL in acute myeloid leukemia. Proc Natl Acad Sci U S A 97 , 2145-50 (2000).
103. Engers, R. et al. Tiam1 mutations in human renal-cell carcinomas. Int J Cancer 88 , 369-76 (2000).
104. Fernandez-Zapico, M. E. et al. Ectopic expression of VAV1 reveals an unexpected role in pancreatic cancer tumorigenesis. Cancer Cell 7 , 39-49 (2005).
105. Malliri, A. et al. Mice deficient in the Rac activator Tiam1 are resistant to Ras-induced skin tumours. Nature 417 , 867-71 (2002).
106. Malliri, A. et al. The rac activator Tiam1 is a Wnt-responsive gene that modifies intestinal tumor development. J Biol Chem 281 , 543-8 (2006).
107. Wolf, R. M. et al. p190RhoGAP can act to inhibit PDGF-induced gliomas in mice: a putative tumor suppressor encoded on human chromosome 19q13.3. Genes Dev 17 , 476-87 (2003).
108. Yang, C., Liu, Y., Leskow, F. C., Weaver, V. M. & Kazanietz, M. G. Rac-GAP-dependent inhibition of breast cancer cell proliferation by {beta}2-chimerin. J Biol Chem 280 , 24363-70 (2005).
109. Menna, P. L. et al. Inhibition of aggressiveness of metastatic mouse mammary carcinoma cells by the beta2-chimaerin GAP domain. Cancer Res 63 , 2284-91 (2003).
110. Stebbins, C. E. & Galan, J. E. Structural mimicry in bacterial virulence. Nature 412 , 701-5 (2001).
111. Lerm, M., Schmidt, G. & Aktories, K. Bacterial protein toxins targeting rho GTPases. FEMS Microbiol Lett 188 , 1-6 (2000).
112. Bustelo, X. R. Vav proteins, adaptors and cell signaling. Oncogene 20 , 6372-81 (2001).