La marihuana (Cannabis sativa L.) y sus derivados se han empleado tanto médica como lúdicamente desde hace al menos cincuenta siglos. Sin embargo, la estructura química de sus componentes activos (los “cannabinoides”) no se dilucidó hasta principios de los años sesenta. Hubo que esperar casi tras décadas más para que se caracterizaran en nuestro organismo receptores específicos de cannabinoides y moléculas endógenas que se unen a ellos. Todos estos descubrimientos han contribuido no sólo a una extraordinaria expansión en el conocimiento básico de cómo los cannabinoides actúan en nuestro organismo, sino también al renacimiento del estudio de sus propiedades terapéuticas, lo que constituye hoy en día un campo de amplio debate con connotaciones científicas, clínicas y sociales. En este artículo se intenta resumir el estado actual del tema.
C. sativa es la única especie del Reino Vegetal que produce cannabinoides, y en concreto puede sintetizar más de sesenta diferentes. Aunque no se conocen las propiedades farmacológicas de la mayoría de ellos, está ampliamente aceptado que el D 9 -tetrahidrocannabinol (THC) es el más importante tanto por su alta abundancia como por su elevada potencia de acción. Otros cannabinoides como el cannabinol y el cannabidiol pueden aparecer así mismo en altos niveles en la planta, pero su potencia de acción es muy reducida. El THC ejerce una gran variedad de efectos tanto en el sistema nervioso central como en distintas localizaciones periféricas debido a que es similar a unas moléculas producidas por prácticamente todo los animales, incluido el ser humano. Estas moléculas se denominan por ello “cannabinoides endógenos” o “endocannabinoides”, y la anandamida es su principal representante. Es más, se han obtenido en el laboratorio análogos sintéticos de los cannabinoides naturales, que muestran una especificidad y potencia mucho más elevadas, y entre cuyos representantes el patentado como WIN-55,212-2 por la compañía Sterling-Winthrop es quizás el más representativo.
Al ser compuestos farmacológicamente relacionados entre sí, todos los cannabinoides, tanto los endógenos como los de C. sativa y los sintéticos, actúan mediante su unión a idénticos receptores específicos localizados en la superficie celular (Figura 1). Son los denominados receptores de cannabinoides o CB, de los cuales se conocen hoy en día dos tipos diferentes: CB 1 y CB 2 . Como parece lógico suponer, únicamente los tejidos del organismo que poseen estos receptores son blanco de la acción de los cannabinoides. En concreto, los efectos de los cannabinoides tanto sobre el sistema nervioso central como sobre diversas localizaciones periféricas están mediados por el ubicuo receptor CB 1 . Este receptor es especialmente abundante en zonas del sistema nervioso central implicadas en el control de la actividad motora (ganglios basales, cerebelo), memoria y aprendizaje (corteza, hipocampo), emociones (amígdala), percepción sensorial (tálamo) y diversas funciones autónomas y endocrinas (hipotálamo, médula), lo que lógicamente explica que el consumo de marihuana afecte a esos procesos. El receptor CB 1 está presente también en las terminales nerviosas periféricas que inervan la piel y los tractos digestivo, circulatorio y respiratorio, así como en el testículo, el ojo y el endotelio vascular.
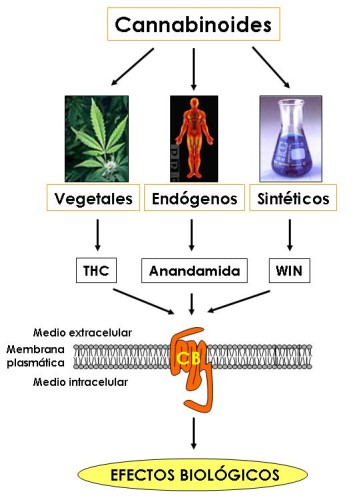 |
Figura 1: Tipos de cannabinoides y sus receptores |
El receptor CB 2 muestra una distribución más restringida, y está fundamentalmente presente en el sistema inmune, tanto en células (por ejemplo linfocitos y macrófagos) como en tejidos (por ejemplo bazo, apéndice y ganglios). Se piensa por ello que este receptor podría estar implicado en la modulación de la respuesta inmune.
Los endocannabinoides, junto con sus receptores y sistemas específicos de síntesis y degradación, constituyen en el organismo el denominado “sistema cannabinoide endógeno”. Desde una pespectiva biológica es curioso que este recién desvelado sistema posea una organización similar a la del bien conocido “ sistema opioide endógeno ”. Así, este último incluye los receptores de opioides (de los cuales hay tres tipos bien caracterizados) a los que se unen una serie de ligandos opioides tanto endógenos (por ejemplo endorfinas y encefalinas) como exógenos vegetales (por ejemplo la morfina, producida por la adormidera) y sintéticos (por ejemplo la codeína).
El sistema cannabinoide endógeno (o al menos parte de sus componentes) aparece de forma altamente conservado en casi todos los grupos de animales, desde Hydra sp. hasta Homo sapiens . Pero ¿se sabe qué funciones puede desempeñar? La función mejor establecida del sistema cannabinoide endógeno es la de constituir un sistema de neuromodulación inhibidora en el cerebro de los mamíferos (Figura 2). Así, cuando aumenta la concentración de ión calcio en el citoplasma de las neuronas postsinápticas, éstas sintetizan precursores de endocannabinoides en la membrana plasmática, y los escinden para liberar a la hendidura sináptica endocannabinoides funcionalmente activos. Esto acontece por ejemplo tras la unión de algunos neurotransmisores como el glutamato a sus receptores ionotrópicos o metabotrópicos. Los endocannabinoides actúan entonces como mensajeros químicos retrógrados, esto es, se unen a receptores CB 1 de las neuronas presinápticas, lo que dificulta la entrada de iones calcio (por el cierre de canales de calcio sensibles a potencial) y facilita la salida de iones potasio (por la apertura de canales rectificadores de potasio) en la célula. Ello impide la despolarización de la membrana y la exocitosis, y así se bloquea la liberación de neurotransmisores como el glutamato en la corteza, la dopamina en los ganglios basales y el ácido g -aminobutírico y la acetilcolina en el hipocampo, lo que afecta a procesos como el aprendizaje, el movimiento y la memoria, respectivamente.
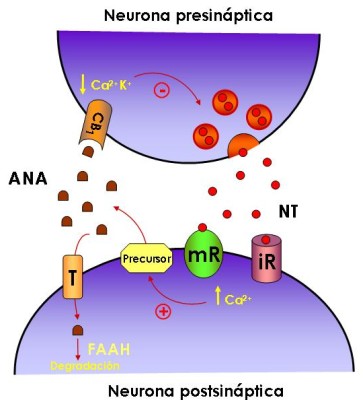 |
Figura 2: El sistema cannabinoide endógeno como sistema neuromodulador |
La acción neuromoduladora de los endocannabinoides finaliza mediante la captura celular de éstos a través de un transportador de membrana y la posterior degradación intracelular, que corre a cargo de una familia de enzimas entre las cuales la ácido graso amidohidrolasa (FAAH, del inglés fatty acid amide hydrolase ) es la mejor caracterizada.
La marihuana ( Cannabis sativa L.) se ha empleado en medicina desde hace al menos cincuenta siglos. Sin embargo, la utilización clínica de esta planta y sus componentes activos está hoy en día bastante restringida. En la actualidad se permite en algunos países la prescripción de THC (Marinol Ò ) y/o del cannabinoide sintético nabilona (Cesamet Ò ) para estimular el apetito e inhibir la nausea y el vómito en pacientes de sida o cáncer tratados crónicamente con agentes quimioterapéuticos. De esta forma se puede impedir la pérdida de peso asociada a la quimioterapia, sin duda uno de los efectos más negativos de ella y que conduce a muchos pacientes a abandonarla.
Entre otros usos clínicos potenciales de los cannabinoides, cuyo estudio se encuentra en fase III de ensayos clínicos, podríamos destacar el tratamiento del dolor oncológico y neuropático (ver http://www.gwpharm.com ; el Sativex Ò , un medicamento que contiene THC y cannabidiol, se acaba de registrar en Canadá y Reino Unido para el tratamiento del dolor neuropático asociado a la esclerosis múltiple), los trastornos del movimiento (espasmos y temblores) asociados a enfermedades neurodegenerativas como la esclerosis múltiple (ver http://www.cannabis-trial.plymouth.ac.uk), y la recuperación de los traumatismos craneoencefálicos (ver http://www.pharmoscorp.com). Existen además otras posibilidades terapéuticas de los cannabinoides que aún se hallan en fases I y/o II de ensayos clínicos o en fases preclínicas. Por ejemplo, nuestro grupo de trabajo ha observado que los cannabinoides inhiben el crecimiento de determinadas células cancerosas, lo que podría hacer de ellos agentes antitumorales.
Los cannabinoides son sustancias bastante seguras. No se han descrito casos de muerte por intoxicación aguda en humanos, y las dosis letales medias son prácticamente imposibles de calcular. La dependencia a cannabinoides observada en algunos modelos animales no parece ser fácilmente extrapolable a humanos que consumen marihuana o sus derivados. Existen así mismo datos que muestran que los cannabinoides no poseen efectos tóxicos generalizados; es más, en algunos casos se ha descrito que los cannabinoides podrían proteger a las neuronas frente al daño producido por agentes oxidantes, isquemia y ciertos neurotóxicos.
A pesar de todo ello, el uso de los cannabinoides en medicina legal está principalmente dificultado por sus efectos psicoactivos, entre los que se incluyen los de tipo afectivo (euforia), somático (somnolencia, descoordinación motora), sensorial (alteraciones en la percepción temporal y espacial, desorientación) y cognitivo (lapsos de memoria, confusión). Aunque dichos efectos secundarios están dentro de los márgenes aceptados para otros medicamentos, pueden tener en casos concretos una vertiente positiva (relajación, conciliación del sueño, buen humor) y tienden a desaparecer tras su administración prolongada (proceso que se conoce como “tolerancia”), está claro que al menos para determinados pacientes y patologías sería deseable diseñar cannabinoides que carecieran de acciones psicotrópicas. Puesto que éstas dependen de los receptores CB 1 del cerebro, la opción más lógica es evitar la activación de estos receptores. Así, se está intentando diseñar (i) compuestos que se unan selectivamente al receptor CB 2 , (ii) compuestos que no atraviesen la barrera hematoencefálica y por tanto no alcancen el cerebro, (iii) vías de administración local y controlada fuera del cerebro, y (iv) regímenes de tratamiento (dosis, ciclos) que optimicen los beneficios terapéuticos y minimicen los efectos secundarios. Los próximos años serán sin duda testigos de grandes avances en este terreno.
La comunidad científica se encuentra hoy en día en un punto en el cual se ha acumulado un conocimiento relativamente bueno de cómo actúan molecularmente los cannabinoides en el organismo y de cuáles pueden ser algunas de sus aplicaciones terapéuticas más inmediatas. Sin embargo, es necesario llevar a cabo investigación básica más profunda y ensayos clínicos más exhaustivos. Este artículo pretende ser un reclamo para atraer la atención de investigadores básicos y clínicos a este apasionante tema.