El agua es el principal componente de células y tejidos de todos los organismos, y la manera de cómo se regula la entrada y salida del agua en las células debe de ser uno de los aspectos más importante en el estudio de la fisiología de los organismos en general. La comprobación de la existencia de las acuaporinas (AQPs)1 o canales de agua ha creado un reto para poder definir su papel en la biología celular y fisiología de todos los organismos. Tan grande ha sido el impacto del descubrimiento y estudio de estas proteínas que el año pasado se concedió el premio Nobel a Peter Agre2, el investigador que identificó por primera vez a estas proteínas y quien las ha estudiado en profundidad, obteniendo recientemente la estructura cristalina de una de ellas3. Debido a que en las plantas, a diferencia de los demás organismos, las AQPs forman una gran familia génica, se podría inferir que las AQPs juegan un papel primordial en los procesos biológicos de las plantas en general. Por esto asumimos que en las plantas se requiere de la presencia de AQPs en las membranas de los diferentes organelos celulares, en los diferentes tejidos, expresadas a diferentes tiempos, y reguladas bajo diferentes condiciones ambientales y de desarrollo. La expresión de AQPs en las plantas también se encuentra regulada a nivel transcripcional y pos-traduccional por fosforilación y glicosilación4.
Hasta hace algunos años se pensaba que el paso del agua a través de las membranas era por simple difusión, cruzando la bicapa lipídica, sin embargo, existían evidencias que sugerían que la entrada y salida de agua de algunas células (glóbulos rojos y células de los tubos proximales y dístales del riñón) debería de estar mediado por un sistema que selectivamente dejaban pasar el agua a través de las membranas4, 5, No fue sino hasta el descubrimiento de una proteína integral de membrana de 28 kD aislada de eritrocitos y del riñón, que se pudo demostrar la presencia de los canales de agua o acuaporinas (AQPs). Esta proteína llamada AQP1, consta de seis dominios transmembrana con los extremos amino y carboxilo terminales ubicados del lado citoplásmico, lo cual presenta una organización similar a la de los canales iónicos (Figura 1). La secuencia del cDNA reveló una similitud entre los primeros tres segmentos transmembranales con los tres últimos, lo cual sugirió que el gen AQP1 es el resultado de una duplicación génica. Las asas que conectan el segundo y tercer segmento transmembranal en cada mitad de la proteína contienen varios residuos altamente homólogos, y la firma NPA (asparagina-prolina-alanina) orientadas a 180º una de la otra6 (Figura 1). En la época en que esta proteína se identificó existían en los bancos de datos algunas secuencias homólogas, como la del cristalino de los bovinos, del cerebro de Drosophila, en bacterias y en plantas, sin embargo, no se conocía las funciones de estas proteínas4. Estos genes se agruparon en una familia altamente conservada de proteínas intrínsecas de membrana llamada MIP (Membrane Integral Proteins), que presentan, además de las características señaladas anteriormente, proteínas con una masa molecular de entre 26 y 32 kD.
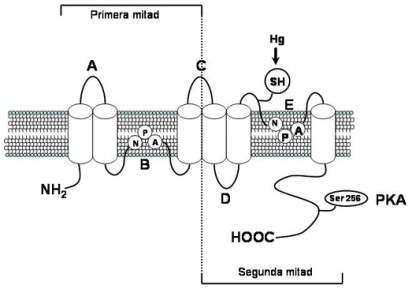 |
| Figura 1. Estructura de las acuaporinas, mostrando los seis dominios transmembrana, señalando las zonas de duplicación génica (primera y segunda mitad), el sitio de inhibición por mercurio (Hg2+), las asas B y E con las firmas asparagina-prolina-alanina (NPAs), las regiones amino (NH2) y carboxilo (COOH), y la serina 256, el sitio de fosforilación por la quinasa A de proteínas (PKA). |
En base a estudios que demostraban que las secuencias homologas a AQP1 en plantas y humanos se expresaban en tejidos altamente permeables al agua, se considero la posibilidad de que AQP1 pudiera ser un canal de agua. Para comprobar esta hipótesis, se expresó a la AQP1 en ovocitos de rana (Xenopus leavis), los cuales normalmente presentan una baja permeabilidad al agua. Cuando los ovocitos de rana inyectados con el cRNA de esta proteína se colocaron en una solución hipo-osmótica se observó un incremento en la permeabilidad al agua, causando hinchamiento y eventualmente el rompimiento del ovocito. Los incrementos en la permeabilidad al agua presentaban una baja energía de activación, fueron inhibidos por Hg2+, y no estaban acompañados con cambios en la corriente eléctrica del ovocito5. Estas características se repitieron en experimentos de reconstitución de esta proteína en bicapas lipídicas, lo que demostró que la AQP1 realmente funcionaba como un canal de agua5.
Debido a la permeabilidad tan particular que presentan, se ha realizado un gran esfuerzo para obtener la estructura molecular de las AQPs. Como se mencionó anteriormente, en base a la secuencia de aminoácidos se han podido identificar dos regiones muy similares, el asa citoplásmica B y el asa extracelular E, cada una conteniendo la secuencia conservada NPA (Figura 1). La presencia de cisteínas en posiciones cercanas a estas secuencias (cisteína 189) hace que las AQPs sean sensibles a los compuestos mercuriales7. Substituciones conservadas con aminoácidos más voluminosos en regiones cercanas a las asas B y E causaron una disminución en la permeabilidad de AQP1, así como una falla en su localización a la membrana plasmática (PM)7. En conjunto, estos resultados condujeron a los investigadores a proponer que los monómeros de las AQPs poseen un poro acuoso en forma de reloj de arena constituido por las asas B y E, las cuales se doblan hacia el interior de la bicapa lipídica desde lados opuestos y entrando en contacto a la mitad de la bicapa6, 7. Aunque cada monómero puede ser funcional y mediar el movimiento de agua a través de las membranas, estudios sobre la velocidad de sedimentación, inmunoprecipitación y el análisis de polipéptidos diméricos de AQP1 sugieren que los canales de agua forman oligómeros6, 7. La estructura mas detallada se obtuvo mediante cristalografía y la reconstitución de AQP1 en altas concentraciones de proteína en membranas lipídicas, lo cual condujo a la formación de “cristales de membrana” que mantuvieron su capacidad de transportar agua y que ayudó a obtener la visión de que las AQPs forman tetrámeros8, 9 a través de los cuales ocurre el movimiento masivo del agua en respuesta a un gradiente osmótico.
Para determinar la función de las AQPs en plantas se han llevado a cabo diferentes estudios sobre las propiedades de los canales de agua, como son, la presencia de una alta permeabilidad osmótica, sensibilidad al Hg2+, una baja dependencia de la temperatura, lo que refleja una baja energía de activación, y que la razón entre la permeabilidad osmótica (Pf ) y la permeabilidad difusional del agua (Pd) sea mayor a uno (Pf/Pd >1). Estos parámetros se han medido en vacuolas, protoplastos, células intactas, en raíces completas y en vesículas aisladas de PM, y tonoplasto (TP) de varias especies vegetales10. De estos estudios se ha observado que la permeabilidad osmótica del TP es mucho mayor que la de la PM10, 11, 12, lo cual es consistente con la idea de que la vacuola es capaz de controlar el balance iónico del citoplasma. Esto sugiere que las AQPs de la PM deben de tener diferentes propiedades que les permiten tener un mejor control del flujo de agua a través de ésta membrana. La permeabilidad de las AQPs de la PM al agua ha sido demostrada mediante el uso de la técnica de silenciamiento de genes del subgrupo de AtPIP1, la cual comprende cinco genes que transportan agua en protoplastos aislados de Arabidopsis thaliana13. Las plantas de A. thaliana expresando el antisentido de AtPIP1;2 mostraron un crecimiento del sistema radicular cinco veces mayor al de las plantas no transformadas. El aumento en el sistema radicular de las plantas transformadas se interpretó como la necesidad de incrementar la superficie de absorción de la raíz para así poder compensar la disminución en la conductividad hidráulica que las células de la raíz sufren al silenciar esta AQP13. La expresión del antisentido de un homólogo de esta proteína en tabaco (NtAQP1) demostró que al menos el 55 % de la conductividad hidráulica de las raíces de estas plantas esta determinada por el subgrupo de las PIP114. Contrario a lo observado en las plantas de A. thaliana, estas plantas no presentaron un fenotipo diferente al de las plantas silvestres14. Utilizando dos mutantes “knock-out” de AtPIP2;2 se comprobó que esta AQP contribuye significativamente a la permeabilidad al agua de las células de la corteza de la raíz, demostrando que esta AQP participa en el transporte osmótico del agua en la raíz15. Estos resultados demuestran que a pesar de la gran cantidad de isoformas de AQPs en plantas, estas isoformas han evolucionado sin presentar una redundancia funcional.
Mediante el uso de plantas transgénicas con el antisentido de AtPIP1;1, Kaldenhoff y colaboradores16 observaron que el cambio de volumen en protoplastos fue menor y mas lento en respuesta a un cambio osmótico, comparado con las plantas silvestres, sugiriendo que la expresión del antisentido provocó una disminución en la permeabilidad al agua. El fenotipo de estas plantas transgénicas fue similar al observado en plantas expuestas a estrés hídrico16.
El análisis de la expresión heteróloga de AQPs de origen vegetal en ovocitos de X. leavis ha sido uno de los métodos ampliamente utilizados para determinar la función de las AQPs en plantas. Varios mRNA de MIPs correspondientes al TP y PM se han inyectado en ovocitos, los cuales han causado que la permeabilidad al agua de estas células aumente entre 2 a 20 veces17, 18, 19, 20. La expresión de MIPs en ovocitos, además de demostrar la función de estas proteínas, también se utiliza para estudiar su topología, oligomerización, regulación post-traduccional y selectividad.
La lista de solutos pequeños que pueden moverse a través de las AQPs en plantas ha aumentado recientemente, estos estudios se han realizado utilizando diferentes métodos como son, expresión heteróloga en ovocitos de X. laevis y en mutantes de levadura en el transporte de metabolitos. El transporte de otros metabolitos por las AQPs que comúnmente se han estudiado son la urea y el glicerol. La primera MIP que se identificó que además de agua transporta glicerol y urea fue GmNOD26 de soja21, y posteriormente NtAQP122 y NtTIPa23 ambas de tabaco. Mutantes de levadura en el transporte de urea fueron complementadas con las AQPs, CpNIP1, similar a NOD26 de calabaza, AtTIP2;1 y AtTIP1;1 de A. thaliana24, sugiriendo que estas AQPs también median el transporte de urea in vivo. En Chara corallina25 mediante el uso de la sonda de presión (pressure probe) se demotró que las AQPs transportan H2O2. Este estudio se debe interpretar con cuidado ya que los experimentos se llevaron a cabo utilizando concentraciones no fisiológicas de H2O2, y lo más importante es que el H2O2 es tan tóxico para las células que inmediatamente que entra a éstas es eliminado, por lo que la existencia de un mecanismo de transporte que saque este compuesto del interior de la célula podría ser redundante y muy difícil de explicar.
Durante los últimos años se han caracterizado AQPs en más de 30 especies vegetales incluyendo mono y dicotiledóneas. La gran abundancia de AQPs en plantas (en A. thaliana existen 38 genes que codifican para AQPs26; Figura 2) comparada con la de los animales en los cuales se han identificado 10 genes, sugiere varias posibilidades. Una, las AQPs en plantas se puedan encontrar distribuidas en membranas de los diferentes compartimentos celulares (mitocondria, cloroplasto, peroxisomas, retículo endoplásmico, Golgi, diferentes tipos de vacuolas y otro tipo de vesículas)17. La presencia de AQPs en los diferentes compartimentos pudiera ser el mecanismo que las células utilizan para regular los cambios en el potencial osmótico que sufren durante los diferentes tipos de estrés a los que las plantas se ven sometidas continuamente. Una segunda posibilidad sería que la expresión de algunas de las AQPs puede depender, ya sea del estado de desarrollo de la planta, o de las condiciones ambientales a las que está expuesta. Finalmente, las AQPs también median el transporte de solutos pequeños como manitol, urea y amoníaco19.
Por análisis filogenético las AQPs de plantas se han agrupado en cuatro familias: las proteínas intrínsecas de la PM (PIPs), las proteínas intrínsecas del TP (TIPs), las pequeñas proteínas básicas integrales (SIPs)26, 27, 28, y las proteínas parecidas a la nodulina 26 (NIPs), grupo donde se encuentran aquellas proteínas que facilitan el transporte de glicerol (Figura 2).
Las proteínas NIP están agrupadas por tener una alta homología con la proteína NOD26, la cual es una acuagliceroproteína, que transporta agua y glicerol, y que se encuentra expresada en la membrana peribacteroidal de los nódulos simbióticos de la raíz de plantas leguminosas29, 30 . Dentro de este grupo se encuentran 8 genes homólogos en el genoma de A. thaliana, y actualmente se desconocen la localización celular, la función y los patrones de expresión de estos genes en las especies vegetales que no presenta la formación de nódulos simbióticos. La subfamilia de genes SIP solo se ha identificado por análisis computacional, ya que los productos de estos genes no se han podido caracterizar experimentalmente.
La mayoría de los genes agrupados en la familia de los MIPs en plantas poseen las propiedades de los MIPs identificados en otros organismos como son: un peso molecular entre 26 y 32 kD, seis dominios transmembrana y los dominios NPA en las dos mitades de la proteína.
Los SIPs y NIPs no poseen todas estas características, sin embargo, presentan los dominios conservados NPA, los cuales les otorgan la capacidad de ser permeables al agua y formar un poro estable en la membrana lipídica.
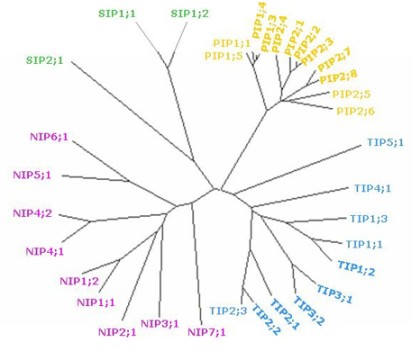 |
| Figura 2. Relación entre las secuencias deducidas de proteínas que codifican para AQPs en Arabidopsis thaliana. El árbol se construyó utilizando los programas “Cluster-X y TreeView”75, 76. Se pueden identificar las cuatro subfamilias; TIP (azul), PIP (amarillo), NIP (rosa) y SIP (verde). La longitud de cada rama es proporcional a la divergencia entre cada secuencia de proteína y todos los miembros de la misma subfamilia. |
Estudios estructurales y proyecciones de cristales de dos dimensiones indican que al menos dos de estas proteínas de plantas, AtTIP3;1 y AtPIP2;3, presentan una estructura típica tetramérica, y cada monómero forma un poro funcional individual1. Con respecto a la clasificación de TIPs y PIPs, como proteínas intrínsecas de membrana que se localizan en el TP y en la PM, respectivamente, existen evidencias de que esta clasificación no es correcta, ya que se ha observado que algunas de las AQPs clasificadas dentro de estas dos sub-familias no necesariamente se expresan en el TP o PM, sino que se localizan en las membranas de otros organelos intracelulares31, 32.
En general, cuando las plantas detectan cambios en la disponibilidad del agua en el medio que las rodea, sufren una alteración en el potencial osmótico. Para balancear estos cambios, las células vegetales requieren llevar a cabo la regulación en la actividad y/o expresión de los diferentes mecanismos de transporte de solutos y agua presentes en sus membranas. Se ha demostrado que estímulos ambientales tales como, la sequía y la salinidad, así como incrementos en la síntesis del regulador del crecimiento vegetal, el ácido abscísico (ABA; relacionado con la percepción del estrés osmótico), traen como consecuencia cambios en la regulación de los niveles de expresión de AQP del TP y de la PM. La inducción de las AQPs a nivel de transcrito durante el estrés osmótico se ha reportado en diferentes tejidos y especies vegetales: en plántulas y partes aéreas de A. thaliana (AtPIP2;7 y AtTIP1;233; AtPIP2;334, 35; AtTIP1;1 y AtTIP2;1)35, partes aéreas de chícharo (trg31)36, tallos de tomate (pTOM75)37, anteras e inflorescencia de la coliflor (mipA38; BobTIP2639), raíces y partes aéreas del arroz (rTip1)40, 41, hojas y raíces de girasol y de la planta de resurrección (SunTIP742, 43; CpPIPa6, CpPIPa7, CpPIPa244), y en las hojas de Nicotiana glauca (NgMIP5)45. En contraste con estos resultados, se ha observado que el estrés osmótico causa una disminución de la expresión de los mRNA de AQPs en hojas, raíces y tallos de N. glauca (NgMIP2, NgMIP3 y NgMIP4)45, raíces de girasol (SunTIP18)43, y en raíces y hojas de Mesembryanthemum crystallinum (McMipA y McMipC)46.
Trabajos recientes apoyan el papel de algunas AQPs en la tolerancia al estrés hídrico. Mediante la manipulación de los niveles de transcrito de algunas PIPs47, ya sea mediante la supresión del mRNA por antisentidos13, 14, 48 o por inserción de T-DNAs15, se ha observado que la represión de la expresión de las AQPs resulta en cambios en la conductividad hidráulica en las raíces, en la velocidad de transpiración, y cambios en la permeabilidad osmótica, y en algunos casos se afecta la capacidad de las plantas para recuperarse en suelos deficientes en agua14, 47, 48.
Pocos trabajos se han enfocado hacia el estudio de la regulación de la expresión de las AQPs por estrés osmótico a nivel de proteína. Sin embargo, cuando factores como estabilidad de mRNA y alteración en la expresión de la proteína se toman en consideración, existen evidencias que sugieren que la regulación a nivel transcripcional no coincide con los cambios en los niveles de proteínas. Por ejemplo, estudios realizados sobre la expresión de AtPIP2;3 en A. thaliana indican que mientras la sequía induce la expresión del gen a nivel transcripcional35, a nivel de la proteína no se observa cambio alguno49.
En la halófila M. crystallinum, utilizando anticuerpos péptido-específicos, hemos observado que existe una regulación diferencial en los niveles de expresión de las diferentes AQPs por estrés salino y por estrés osmótico. Por ejemplo, durante el estrés salino, la cantidad de la proteína McTIP1;2 se reduce en el TP de las hojas mientras que un incremento de McPIP2;1 ocurre en la raíz. Al mismo tiempo, no se observaron cambios en la expresión de McPIP1;4 y McPIP1;2 en ningún tejido de la planta33, 50 (Vera-Estrella et al, datos no publicados). El estrés osmótico causó un aumento en los niveles de expresión de la proteína McTIP1;2 en las hojas y en la raíz, que contrastan con la disminución causada por el estrés salino15. Estos resultados sugieren que la planta es capaz de discriminar exactamente entre el estrés iónico y el estrés osmótico, posiblemente a través de diferentes mecanismos de transducción de señales involucrados en la adaptación de M. crystallinum a estos tipos de estrés. Además de un aumento en los niveles de expresión de McTIP1;2 en el TP causados por el estrés osmótico, hemos observado que existe un cambio en la distribución de esta proteína en las diferentes endomembranas aisladas de las hojas y de células en suspensión de M. crystallinum, el cual se correlaciona con los cambios en el potencial osmótico de las células33. Sin embargo, estos cambios de distribución de McTIP1;2 no se observan en las raíces de las mismas plantas, en las cuales sólo se observa un incremento en la cantidad de proteína en la fracción correspondiente al TP. Los cambios en la distribución de McTIP1;2 en las diferentes endomembranas sugiere la participación del tráfico vesicular durante esta respuesta, el cual puede ser un mecanismo importante de regulación de la expresión de esta proteína y la participación de las AQPs en la regulación del estrés hídrico en compartimentos celulares diferentes a la PM y el TP17.
Las AQPs que se expresan en el TP se han caracterizaron por su abundancia en las semillas de frijol51, raíces del rábano52, hojas de espinacas53, maíz18, tabaco54, A. thaliana55, y M. crystallinum50. Aparte del TP de la vacuola central, las AQP pertenecientes a la subfamilia de las TIPs, se localizan en membranas de otras vesículas, incluyendo, vacuolas almacenadoras de proteínas, vacuolas líticas, vacuolas autofágicas y vacuolas densas en electrones56. Estas observaciones sugieren que las TIPs caracterizan al tipo de compartimento en donde se localizan, así como el estado de desarrollo de la vesícula. Sin embargo, se pueden encontrar diferentes TIPs en la membrana de un mismo tipo de vesícula56. La complejidad aumenta si consideramos que cambios en el medio ambiente pueden desencadenar la formación de nuevas vesículas57, 58. Aunado a esto se encuentra la evidencia que sugiere que en las células vegetales existen varias rutas independientes para el origen, mantenimiento y abastecimiento de vacuolas59, 60. En M. crystallinum hemos descrito que durante el estrés osmótico, la AQP McTIP1;2 se relocaliza del TP a un compartimiento nuevo cuya función se desconoce. Este compartimiento con características únicas tiene la apariencia de cuerpos multi-vesiculares localizados en el citoplasma, en los cuales se ha detectado la presencia de McTIP1;2 utilizando inmunolocalización con partículas de oro e inmunofluorescencia (Figura 3)17. Es posible que la presencia de McTIP1;2 en la membrana de los cuerpos multi-vesiculares sea importante para mantener un balance osmótico con el citoplasma durante el estrés, el cual induce al mismo tiempo la toma de solutos y iones específicos dentro de estas vesículas17. El hecho de que las AQPs se localizan en diferentes compartimentos celulares es una gran ventaja para el estudio de la biología celular vegetal, pues estas proteínas se pueden utilizar como herramientas para explicar los mecanismos de biogénesis y destino final de las proteínas en las células vegetales.
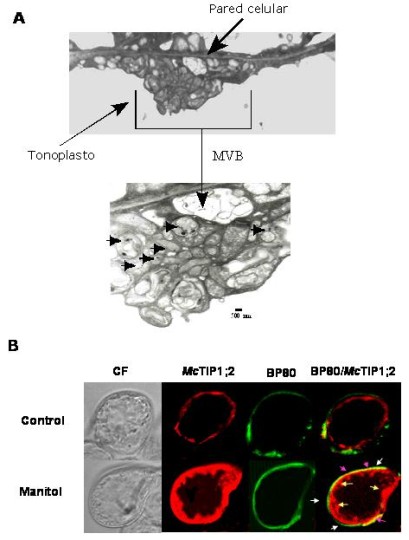 |
| Figura 3. Representación esquemática de los mecanismos que regulan la re-distribución de McTIP1;2 en las diferentes membranas de M. crystallinum. Esta ruta es propuesta por la activación (+) o inhibición (—) por wortmanina, Forskolina, 2’,5’dideoxiadenosina (2,5-D), N-2-pBromocinamil-etil-5-isoquinolinesulfonamida (H89), brefeldina A, citocalasina D, 8 Bromo-monofosfato de adenosina 3’,5’-ciclica, (8Br-cAMP), o tunicamicina. |
La localización membranal de las PIPs se determinó en sus inicios utilizando membranas aisladas por el método de partición en dos fases acuosas, lo cual sugirió que estas proteínas se expresaban exclusivamente en la PM16, 27, 49. Sin embargo, evidencias más recientes han demostrado que esto no es así. Por ejemplo, se ha demostrado que la AQP de A. thaliana AtPIP1:1, se localiza en “plasmalemmasomas“, las cuales son vesículas endosomales que se sugiere, se originan como resultado de invaginaciones de la PM, cuyo significado fisiológico es desconocido61. Aunque se ha sugerido que este mecanismo favorece el intercambio de AQPs mediante el reciclado de vesículas entre la superficie y el interior de la célula. Por otro lado, el transgen de la AQP de maíz ZmPIP1b-sGFP expresado en tabaco se localiza tanto en la PM como en la región perinuclear, lo cual sugiere que esta AQP podría localizarse en organelos específicos involucrados en la ruta secretora, más que en la PM62. Sin embargo, podría ser posible que esta diferencia se deba a la fusión génica en sí, o al hecho de emplear un sistema de expresión heterólogo. La inmunolocalización de tres PIPs de M. crystallinum, (McPIP1;4, McPIP1;2, y McPIP2;1) ha demostrado que McPIP1;4 no se localiza en la PM31, 50 sino en fracciones más ligeras que el TP y la PM, correspondientes a compartimentos prevacuolares. La AQP McPIP2;1 se detectó en fracciones intermedias entre el TP y la PM, en compartimentos de origen desconocido (Vera-Estrella, datos no publicados). La presencia de PIPs en membranas intracelulares puede ser un indicio del tráfico vesicular desde el lugar de síntesis de la proteína hasta la PM. La presencia de un sistema de intercambio de AQPs entre los diferentes compartimentos celulares podría permitir una regulación mas fina de la expresión de estos canales en los sitios donde se requiere su participación durante condiciones particulares, lo cual se asemeja al mecanismo de intercambio de AQP2 en el riñón61. Alternativamente, la distribución diferencial de las PIPs de M. crystallinum puede sugerir que estas proteínas realmente participan en el control del flujo de agua en los diferentes compartimentos intraceulares17.
Además de la regulación de la expresión de las AQPs a nivel transcripcional existen evidencias que sugieren que su actividad y/o especificidad puede ser regulada a nivel post-traduccional. Por ejemplo, en frijol la fosforilación dependiente de Ca2+ causa una estimulación en la actividad de AtTIP3;163. Por medio de estudios de expresión de esta proteína en tabaco se ha podido observar que AtTIP3;1 puede ser fosforilada en los compartimentos prevacuolares por una quinasa de proteínas dependiente de Ca2+ (CDPK)64. También se ha demostrado que las CDPKs son capaces de fosforilar NOD26 y PM28a, en la membrana del simbiosoma de los nódulos del fríjol y en la PM de las hojas de espinaca, respectivamente65, 66. Es interesante hacer notar que la fosforilación de AtPIP2;3 es dependiente del potencial osmótico extracelular64. La regulación de las AQPs por fosforilación se ha estudiado mediante la expresión heteróloga de las AQPs AtTIP3;1 y AtPIP2;3 en ovocitos de X. laevis63, 67. Empleando agonistas y antagonistas de quinasas y fosfatasas de proteínas se demostró que la permeabilidad de AtTIP3;1 y AtPIP2;3 aumentó cuando se fosforilaron los sitios de reconocimiento de una CDPK63, 67. Estudios realizados con NOD26 reconstituida en bicapas lipídicas demostraron que la fosforilación de esta proteína por una CDPK de plantas aumentó la actividad de esta AQP68. Se ha propuesto que la fosforilación de las AQPs de plantas afecta a la apertura y cierre del poro, y de esta manera, regula la actividad de las mismas, contrastando este hecho con lo descrito en AQPs de animales en donde la fosforilación es importante para el tráfico de estas proteínas desde membranas intracelulares a la PM. Sin embargo, recientemente hemos demostrado que la fosforilación de McTIP1;2 es importante durante la re-distribución de esta proteína hacia compartimentos multivesiculares en respuesta al estrés osmótico17. Nuestros resultados sugieren que la participación de los mecanismos de fosforilación en la actividad y/o translocación de las AQPs en las plantas es un aspecto importante que se debe de investigar con mayor profundidad.
En base a los resultados que obtuvimos sobre el control de la re-distribución de McTIP1;2 por fosforilación, resultó importante determinar si otros mecanismos podrían participar en la respuesta inducida por el estrés osmótico. Mediante el uso de inhibidores específicos y con ayuda de la microscopia confocal y colorantes fluorescentes17, hemos observado que la re-distribución de McTIP1;2 se inhibe cuando las células en suspensión de M. crystallinum se pre-incuban con brefeldina A, wortmanina, o citocalasina D (inhibidores de la biosíntesis de vesículas, de la fosfatidilinositol 3-fosfato quinasa [PI3K], y de la actina, respectivamente), mecanismos directamente involucrados en el tráfico vesicular17. También hemos observado que la re-distribución de McTIP1;2 causada por el estrés osmótico está regulada por el cAMP, ya que esta respuesta puede ser inducida tanto por forskolina como por el 8-Br-cAMP (activadores de la adenilato ciclasa [AC] y de la PKA, respectivamente) en ausencia del estrés osmótico17. Estas respuestas son inhibidas por 2,5-D y H89 (inhibidores de AC y PKA, respectivamente, Figura 4). Además hemos demostrado que la glicosilación de McTIP1;2 es un requisito esencial para que esta proteína se mueva a otro(s) organelo(s) celular(es) ya que en presencia de tunicamicina (inhibidor de la glicosilación), el estrés osmótico no induce la relocalización de McTIP1;2 (Figura 4). De estos resultados, podemos concluir que la re-distribución de McTIP1;2 hacia organelos celulares forma parte del (los) mecanismo(s) de regulación indispensables para que la célula sea capaz de restaurar y mantener la homeostasis celular durante el estrés osmótico17 (Figure 4).
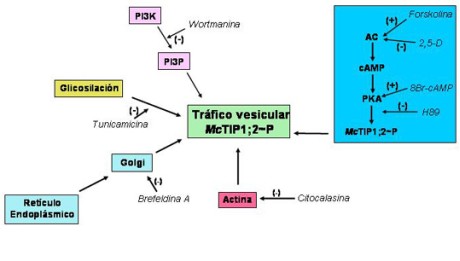 |
| Figura 4. Inmunolocalización de McTIP1;2. A. Los cuerpos multivesiculares (MVB) en el citoplasma de células de hojas de la halófita M. crystallinum son inducidos por la incubación con 200 mM de manitol durante 5 días. La parte inferior muestra la immunolocalización de McTIP1;2 con partículas de oro (→) dentro de los cuerpos multivesiculares. B. Co-localización de McTIP1;2 y el receptor de compartimentos prevacuolares (BP80) en células en suspensión crecidas en ausencia (control) y presencia de manitol 200 mM. (CF) contraste de fases; (BP80) localización de BP80 en color verde; (McTIP1;2) localización de McTIP1;2 en color rojo; (BP80/McTIP1;2) co-localización de BP80 y McTIP1;2 en color amarillo. |
Sabemos por trabajos descritos en la literatura que en humanos y ratas, la regulación de AQP se lleva a cabo por medio de su reciclaje entre membranas, lo cual se ha demostrado en tres de las 10 AQPs que existen en el genoma humano. La vasopresina, incrementa la permeabilidad al agua de los tubos colectores del riñón mediante una vía de señalización en la que participan cAMP y PKA. Inicialmente, la vasopresina se une a su receptor que activa a una proteína G heterotrimérica resultando en la estimulación de la adenilato ciclasa y el consecuente aumento en cAMP. Estos aumentos en cAMP causan la activación de PKA que fosforila a la AQP2 en la serina 256, causando que las vesículas donde se encuentra localizada se fusionen con la PM vía exocitosis69, 70, 71. Por otro lado también existen evidencias sobre la movilización de la AQP5 de rata desde vesículas intracelulares a la PM72. Ishikawa y colaboradores72 han reportado que la acetilcolina o la epinefrina estimulan el 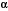 1-adreno-receptor el cual causa un aumento en los niveles de Ca2+ citoplásmico a través del IP3 y los receptores de ryanodina, provocando la translocación de la AQP5 desde membranas intracelulares hacia la PM apical en células de la parótida de ratas72. Para que estos mecanismos se lleven a cabo no se requiere que estas proteínas estén glicosiladas62, pero sí se requiere de la participación del citoesqueleto72. Podemos asumir que a pesar de lo similar de estas respuestas en células animales con lo observado en M. crystallinum, las evidencias puntualizan que la regulación de McTIP1;2 es diferente. Las diferencias mas notorias son que McTIP1;2 se mueve hacia compartimentos intracelulares y no hacia la PM, además de que la re-distribución de McTIP1;2 requiere que la proteína este glicosilada.
1-adreno-receptor el cual causa un aumento en los niveles de Ca2+ citoplásmico a través del IP3 y los receptores de ryanodina, provocando la translocación de la AQP5 desde membranas intracelulares hacia la PM apical en células de la parótida de ratas72. Para que estos mecanismos se lleven a cabo no se requiere que estas proteínas estén glicosiladas62, pero sí se requiere de la participación del citoesqueleto72. Podemos asumir que a pesar de lo similar de estas respuestas en células animales con lo observado en M. crystallinum, las evidencias puntualizan que la regulación de McTIP1;2 es diferente. Las diferencias mas notorias son que McTIP1;2 se mueve hacia compartimentos intracelulares y no hacia la PM, además de que la re-distribución de McTIP1;2 requiere que la proteína este glicosilada.
La existencia de AQPs ha creado un reto en la fisiología vegetal ya que la manera de explicar el uso eficiente del agua por las plantas se ha tenido que reconsiderar21. Aunado a esto, la presencia de una familia tan grande de AQPs en plantas hace este reto aun más complicado26, 73, 74. Por la presencia de esta gran familia se podría deducir que las plantas necesitan las AQPs en las membranas de los diferentes organelos celulares, en los diferentes tejidos a diferentes tiempos y que son reguladas bajo diferentes condiciones ambientales y de desarrollo de la planta. La regulación de la expresión de AQPs a nivel transcripcional, aunada a la regulación pos-traduccional por fosforilación y glicosilación17, así como la re-distribución de McTIP1;2 a endomembranas causada por cambios en las condiciones ambientales, demuestran que el estudio de las AQPs en los sistemas vegetales sea aún más complejo y un reto para la biología vegetal. A pesar de toda la información que se ha obtenido en los últimos años, aún es necesario continuar con estos estudios para entender de manera clara y precisa los patrones de expresión de cada una de las AQPs así como su función.
1. Agre P, Sasaki S, Chrispeels MJ. 1993. Aquaporins: a family of water channel proteins. American. Journal of Physiology, Vol 261: F461.
2. Knepper MA, Nielsen S. 2004. Peter Agre, 2003 Nobel Prize winner in chemistry. Journal of the American Society of Nephrology, Vol 15: 1093-1095.
3. Murata K, Mitsuoka K, Hirai T, et al. 2000. Structural determinants of water permeation through aquaporin-1. Nature, 407: 599-605.
4. Finkelstein A. 1987. Water movement through lipid bilayers, pores, and plasma membranes: Theory and reality. In, Distinguished lecture series of the Society of General Physiology. John Wiley and Sons, New York, Vol 4:166-184.
5. Verkman AS. 1992. Water channels in cell membranes. Annual Review of Physiology, Vol 54: 97-108.
6. Agre P, King LS, Yasui M, et al. 2002. Aquaporin water channels-from atomic structure to clinical medicine. Journal of Physiology, Vol 542: 3-16.
7. Jung JS, Preston GM, Smith BL, et al. 1994. Molecular structure of the water channel through aquaporin CHIP. The hourglass model. Journal of Biological Chemistry, Vol 269: 14648-14654.
8. Walz T, Typke D, Smith BL, et al. 1995. Projection map of aquaporin-1 determined by electron crystallography. Nature Structural Biology, Vol 3: 730-732.
9. Murata K, Mitsuoka K, Hirai T, et al. 2000. Structural determinants of water permeation through aquaporin-1. Nature, Vol 407: 599-605.
10. Maurel C, Javot H, Lauvergeat V, et al. 2002. Molecular physiology of aquaporins in plants. International Review of Cytology, Vol 215: 105-148.
11. Maurel C, Tacnel F, Güclü J, et al. 1997. Purified vesicles of tobacco cell vacuolar and plasma membrane exhibit dramatically different water permeability and water channel activity. Proceedings of the National Academy of Sciences, USA. Vol 94: 7103-7108.
12. Niemietz CM, Tyerman JD. 1997. Characterization of water channels in wheat root membrane vesicles. Plant Physiology, Vol 115:561-567.
13. Kaldenhoff R, Grote K, Zhu J-J, Zimmermann U. 1998. Significance of plasmalemma aquaporins for water transport in Arabidopsis thaliana. Plant Journal, Vol 14: 121-128.
14. Siefritz F, Tyree MT, Lovisolo C, et al. 2002. PIP1 plasma membrane aquaporins in tobacco: from cellular effects to function in plants. Plant Cell, Vol 14: 869-876.
15. Javot H, Lauvergeat V, Santoni V, et al. 2003. Role of a single aquaporin in root water uptake. Plant Cell, Vol 15:509-522.
16. Kaldenhoft R, Kölling A, Meyers J, et al. 1995. The blue light-responsive AthH2 gene of Arabidopsis thaliana is primarily expressed in expanding as well as in differentiating cells and encodes a putative channel protein of the plasmalemma. Plant Journal, Vol 7: 87-95.
17. Vera Estrella R, Barkla BJ, Bohnert HJ, Pantoja O. 2004. Novel regulation of plant aquaporins. Plant Physiology, Vol 135: 2318-2329.
18. Daniels MJ, Chaumont R, Mirkov TE, Chrispeels MJ. 1996. Characterization of a new vacuolar membrane aquaporin sensitive to mercury at a unique site. Plant Cell, Vol 8: 587-599.
19. Tyerman SD, Niemietz CM, Bramley H. 2002. Plant aquaporins: multifunctional water and solute channels with expanding roles. Plant Cell and Environment, Vol 25: 173-194.
20. Chrispeels MJ, Maurel C. 1994. Aquaporins: the molecular basis of facilitated water movement through living plant cells. Plant Physiology, Vol 105: 9-13.
21. Rivers RL, Dean RM, Chang G, et al. 1997. Functional analysis of nodulin 26, an aquaporin of soybean root nodule symbiosomes. Journal of Biological Chemistry, Vol 276: 16256-16261.
22. Biela A, Grote K, Otto B, et al. 1999. The Nicotiana tabaccum plasma membrane aquaporin NtAQP1 is mercury-insensitive and permeable to glycerol. Plant Journal, Vol 18: 565-570.
23. Gerbeau P, Güclü J, Ripoche P, Maurel C. 1999. Aquaporin NtTIP1a can account for the high permeability of tobacco cell vacuolar membrane to small neutral solutes. Plant Journal, Vol 18: 577-587.
24. Klebl F, Wolf M, Sauer N. 2003. A defect in the yeast plasma membrane urea transporter Dur3p is complemented by CpNIP1, a Nod26/like protein from zucchini (Curcubita pepo L.) and by Arabidopsis thaliana 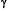 TIP or
TIP or 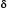 -TIP. FEBS letters, Vol 547: 69-74.
-TIP. FEBS letters, Vol 547: 69-74.
25. Henzler T, Steudle E. 2000. Transport and metabolic degradation of hydrogen peroxide in Chara corallina: Model calculations and measurements with the pressure probe suggest transport of H2O2 across water channels. Journal of Experimental Botany, Vol 51: 2053-2066.
26. Quigley F, Rosenberg JM, Shachar-Hill Y, Bohnert HJ. 2002. From genome to function: the Arabidopsis aquaporins. Genome Biology, Vol 3: 1-17.
27. Kammerloher R, Fischer U, Piechottka GP, Schäffner AR. 1994. Water channels in the plasma membrane cloned by immunoselection from a mammalian expression system. Plant Journal, Vol 6: 187-199.
28. Schäffner AR. 1998. Aquaporin function, structure, and expression: Are there more surprises to surface in water relations? Planta, Vol 204: 131-139.
29. Dean RM, Rivers RL, Zeidel ML, Roberts DM. 1999. Purification and functional recognition of soybean Nodulin 26. An aquaporin with water and glycerol transport properties. Biochemistry, Vol 38: 347-353.
30. Fortin MG, Morrison NA, Verma DPS. 1987. Nodulin 26, a peribacteroid membrane nodulin is expressed independently of the development of the peribacteroid compartment. Nucleic Acid Research, Vol 15: 813-824.
31. Barkla BJ, Vera-Estrella R, Pantoja O, et al. 1999. Aquaporin location- how valid are the TIP and PIP labels? Trends in Plant Sciences, Vol 120: 811-819.
32. Vera-Estrella R, Barkla BJ, Gallardo-Amarillas C, et al. 2000. Aquaporin regulation under salt and osmotic stress in the halophyte Mesembryanthemum crystallinum L. In S Hohmann, S Nielsen, eds, Molecular Biology and Physiology of Water and Solute Transport, Kluwer Academic/Plenum Publishers New York, pp 339-346.
33. Tae Pih K, Kabilan V, Lim JH, et al. 2000. Characterization of two new channel protein genes in Arabidopsis. Molecular Cell, Vol 9: 84-90.
34. Yamaguchi-Shinozaki K, Koizumi M, et al. 1992. Molecular cloning and characterization of 9 cDNAs for genes that are responsive to desiccation in Arabidopsis thaliana: Sequence analysis of one cDNA that encodes a putative transmembrane channel protein. Plant Cell Physiology, Vol 33: 217-224.
35. Weig A, Deswarte C, Chrispeels MJ. 1997. The major intrinsic protein family of Arabidopsis has 23 members that form three distinct groups with functional aquaporins in each group. Plant Physiology, 114: 1347-1357.
36. Guerrero FD, Jones JT, Mullet JE. 1990. Turgor-responsive gene transcription and RNA levels increase rapidly when pea shoots are wilted. Sequence and expression of three inducible genes. Plant Molecular Biology, Vol 15: 11-26.
37. Fray RG, Wallace A, Grierson D, Lycett GW. 1994. Nucleotide sequence and expression of a ripening and water stress-related cDNA from tomato with homology to the MIP class of membrane channel proteins. Plant Molecular Biology, Vol 24: 539-543.
38. Ruiter RK, van Eldik GJ, van Herpen MMA, et al. 1997. Expression in anthers of two genes encoding Brassica oleracea transmembrane channel proteins. Plant Molecular Biology, Vol 34: 163-168.
39. Barrieu F, Thomas D, Marty-Mazars D, et al. 1998. Tonoplast intrinsic proteins from cauliflower (Brassica oleracea L. var. botrytis): immunological analysis, cDNA cloning and evidence for expression in meristematic tissues. Planta, Vol 204: 335-344.
40. Liu Q, Umeda M, Uchimiya H. 1994. Isolation and expression analysis of two rice genes encoding the major intrinsic protein. Plant Molecular Biology, Vol 26: 2003-2007.
41. Samarajeewa PK, Barrero RA, Umeda-Hara C, et al. 1999. Cortical cell death, cell proliferation, macromolecular movements and rTip1 expression pattern in roots of rice (Oryza sativa L.) under NaCl stress. Planta, Vol 207: 354-361.
42. Sarda X, Tousch D, Ferrare K, et al. 1997. Two TIP-like genes encoding aquaporins are expressed in sunflower guard cells. Plant Journal, Vol 12: 1103-1111.
43. Sarda X, Tousch D, Ferrare K, et al. 1999. Characterization of closely related delta-TIP genes encoding aquaporins which are differentially expressed in sunflower roots upon water deprivation through exposure to air. Plant Molecular Biology, Vol 40: 179-191.
44. Mariaux JB, Bockel C, Salamini F, Bartels D. 1998. Desiccation and abscisic acid responsive genes encoding major intrinsic proteins (MIPs) from the resurrection plant Craterostigma plantagineum. Plant Molecular Biology, Vol 38: 1089-1099.
45. Smart LB. Moskal WA, Cameron KD, Bennett AB. 2001. MIP genes are down-regulated under drought stress in Nicotiana glauca. Plant Cell Physiology, Vol 42: 686-693.
46. Yamada S, Katsuhara M, Kelly WB, et al. 1995. A family of transcripts encoding water channel proteins: Tissue-specific expression in the common ice plant. Plant Cell, Vol 7: 1129-1142.
47. Aharon R, Shahak Y, Wininger S, et al. 2003. Overexpression of a plasma membrane aquaporin in transgenic tobacco improves plant vigor under favorable growth conditions but not under drought or salt stress. Plant Cell, Vol 15: 439-447.
48. Martre P, Morillon R, Barrieu F, et al. 2002. Plasma membrane aquaporins play a significant role during recovery from water deficit. Plant Physiology, Vol 130: 2101-2110.
49. Daniels MJ, Mirkov TE, Chrispeels MJ. 1994. The plasma membrane of Arabidopsis thaliana contains a mercury-insensitive aquaporin that is a homolog of the tonoplast water channel protein TIP. Plant Physiology, Vol 106: 1325-1333.
50. Kirch H-H, Vera-Estrella R, Golldack D, et al. 2000. Expression of water channel proteins in Mesembryanthemum crystallinum. Plant Physiology, Vol. 123: 111-124.
51. Johnson KD, Herman EM, Chrispeels MJ. 1989. An abundant highly conserved tonoplast protein in seeds. Plant Physiology, Vol 91: 1006-1013.
52. Maeshima M. 1992. Characterization of the major integral protein of vacuolar membrane. Plant Physiology, Vol 98: 1248-1254.
53. Karlsson M, Johansson J, Bush M, et al. 2000. An abundant TIP expressed in mature highly vacuolated cells. Plant Journal, Vol 21: 83-90.
54. Höfte H, Hubbard L, Reiza J, et al. 1991. Vegetative and seed-specific isoforms of a putative solute transporter in the tonoplast of Arabidopsis thaliana. Plant Physiology, Vol 99: 561-570.
55. Höfte H, Faye L, Dickinson C. 1992. The protein-body proteins phytohemagglutinin and tonoplast intrinsic protein are targeted to vacuoles in leaves of transgenic tobacco. Planta, Vol 184: 431-437.
56. Jauh G-Y, Phillips TE, Rogers JC. 1999. Tonoplast intrinsic protein isoforms as markers for vacuolar functions. Plant Cell, Vol 11: 1867-1882.
57. Marty F. 1999. Plant vacuoles. Plant Cell, Vol 11: 587-599.
58. Paris N, Stanley CM, Jones RL, Rogers JC. 1996. Plant cells contain two functionally distinct vacuolar compartments. Cell, Vol 85: 563-572.
59. Jiang L, Rogers JC. 1998. Integral membrane protein sorting to vacuoles in plant cells: evidence for two pathways. Journal of Cell Biology, Vol 30: 1183-1199.
60. Chrispeels MJ, Herman EM. 2000. Endoplasmic reticulum-derived compartments function in storage and as mediators of vacuolar remodeling via a new type of organelle, precursor protease vesicles. Plant Physiology, Vol 123: 1227-1233.
61. Robinson DG, Sieber H, Kammerloher W, Schäffner AR. 1996. PIP1 aquaporins are concentrated in plasmalemmasomes of Arabidopsis mesophyll. Plant Physiology, Vol 111: 645-649.
62. Chaumont F, Barrieu F, Jung R, Chrispeels MJ. 2000. Plasma membrane intrinsic proteins from maize cluster in two sequence subgroups with differential aquaporin activity. Plant Physiology, Vol 122: 1025-1034.
63. Maurel C, Kado RT, Guern J, Chrispeels MJ. 1995. Phosphorylation regulates the water channel activity of the seed-specific aquaporin 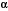 -TIP. EMBO Journal, Vol 14: 3028-3035.
-TIP. EMBO Journal, Vol 14: 3028-3035.
64. Johnson KD, Chrispeels MJ. 1992. Tonoplast-bound protein kinase phosphorylates tonoplast intrinsic protein. Plant Physiology, Vol 100: 1787-1795.
65. Johansson I, Larsson C, Ek B, Kjellbom P. 1996. The major integral proteins of spinach leaf plasma membranes are putative aquaporins and are phosphorylated in response to Ca2+ and apoplastic water potential. Plant Cell, Vol 8: 1181-1191.
66. Weaver CC. 1991. Calcium-dependent phosphorylation of symbiosome membrane proteins from nitrogen-fixing soybean nodules. Plant Physiology, Vol 95: 222-227.
67. Johansson I, Karlsson M, Shukla VK, et al. 1998. Water transport activity of the plasma membrane aquaporin PM28A is regulated by phosphorylation. Plant Cell, Vol 10:451-459.
68. Lee JW, Zhang Y, Weaver CD, et al. 1995. Phosphorylation of Nodulin 26 on serine 262 affects its voltage-sensitive channel activity in plant lipid bilayers. Journal of Biological Chemistry, Vol 270: 27051-27057.
69. Brown D, Katsura T, Gustafson CE. 1998. Cellular mechanisms of aquaporin trafficking. American Journal of Physiology, Vol 275: F328-F331.
70. Nielsen S, Chou CL, Marples D, et al. 1995. Vasopressin increases water permeability of kidney collecting duct by inducing translocation of aquaporin-CD water channels to plasma membrane. Proceedings of the National Academy of Sciences USA, Vol 92: 1013-1017.
71. Knepper MA, Inoue T. 1997. Regulation of aquaporin-2 water channel trafficking by vasopressin. Current Opinion of Cell Biology, Vol 9: 560 564.
72. Ishikawa Y, Skowronski MT, Inoue N, Ishida H. 1999.  1-Adrenoceptor-induced trafficking of aquaporin-5 to the apical plasma membrane of rat parotid cells. Biochemical and Biophysical Research Communications, 265: 94-100.
1-Adrenoceptor-induced trafficking of aquaporin-5 to the apical plasma membrane of rat parotid cells. Biochemical and Biophysical Research Communications, 265: 94-100.
73. Santoni V, Gerbeau P, Javot H, Maurel C. 2000. The high diversity of aquaporins reveals novel facets of plant membrane functions. Current Opinion of Plant Biology, Vol 3: 476-481.
74. Chaumont F, Barrieu F, Wojcik E, Chrispeels MJ, Jung R. 2001. Aquaporins constitute a large and highly divergent protein family in maize. Plant Physiology, 125: 1206-1215.
75. Jeanmougin F, Thompson JD, Gouy M, et al. 1998. Multiple sequence alignment with Cluster X. Trends in Biochemical Sciences, 23: 403-405.
76. Page RDM. 1996. TreeView: an application to display phylogenetic trees on personal computers. Computational Applied Biosciences, 12: 357-358.