Las especies reactivas de oxígeno o ROS(del inglés Reactive Oxygen Species ) son compuestos altamente deletéreos que se producen como consecuencia de procesos de transferencia de energía así como en otros procesos fisiológicos, con frecuencia en respuesta a factores adversos del ambiente [1, 2] . Los organismos, y en particular la plantas, no sólo han desarrollado sistemas para protegerse de estos agentes tóxicos sino que también son capaces de aprovechar las propiedades reactivas de estas moléculas para utilizarlas come señales reguladoras de diferentes procesos. En la respuesta de la planta contra organismos patógenos se observa de manera característica una producción de ROS típicamente bifásica, con una primera fase transitoria seguida de una fase sostenida y de mayor amplitud [3] . Estas dos fases se observan cuando existe reconocimiento del patógeno por parte del producto del gen de resistencia (R) y activación de las defensas inducibles (respuesta incompatible o avirulenta) o cuando, aún sin reconocimiento del patógeno, actúan las defensas basales. La producción menor y transitoria de ROS también se produce cuando el patógeno evade las defensas mediante factores virulentos (respuesta compatible) produciendo la enfermedad del tejido. Así pues, la producción masiva y sostenida de ROS asociada al establecimiento de las defensas sugiere que estas ROS tienen un papel importante en la defensa de la planta al ataque de patógenos.
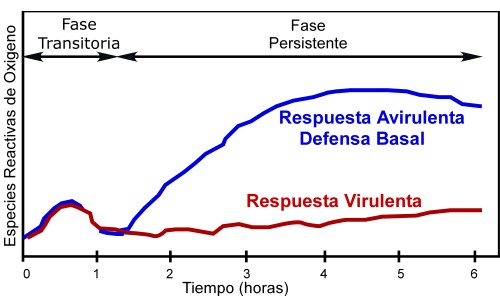 |
Figura 1: Esquema de la producción bifásica de ROS en respuesta a patógenos. |
El presente artículo pretende llevar a cabo una recapitulación del papel que juegan las ROS en la respuesta contra patógenos, haciendo hincapié en los mecanismos que contribuyen a la acumulación de ROS, sus funciones y la interacción con otras moléculas dentro del entramado de señales que gobiernan la respuesta a patógenos y otras respuestas al entorno ambiental.
La alta reactividad de las ROS determina que tengan en general una vida sumamente corta y que atraviesen con dificultad las membranas de la célula [1] . Ello hace que la función reguladora de las ROS venga definida por el balance producción/detoxificación y por su compartimentación [4] . La acumulación de estas especies de oxígeno en diferentes compartimentos de la célula contribuye a limitar su efecto deletéreo de las mismas y permite que la función específica de las mismas se realice de manera controlada.
Los principales derivados del oxígeno detectados en la respuesta contra patógenos son el anión superóxido (O2 - ) y el peroxido de hidrógeno (H2O2 ), y son producidos de manera característica fuera de la membrana plasmática de las células vegetales (apoplasto) [5, 6] . Mediante el uso de inhibidores específicos, dos mecanismos enzimáticos se han postulado como los responsables más probables de esta producción de ROS en el apoplasto. Estudios genéticos recientes han demostrado que la NADPH oxidasa localizada en la membrana plasmática se considera como la principal fuente de ROS en respuesta a varios patógenos [7, 8] . Este enzima es similar al sistema enzimático que produce superóxido en las células fagocíticas animales [9] . En plantas, lo mismo que en animales, existe una familia génica de estas oxidasas (llamadas Rboh , Respiratory burst oxidase homologs ), al igual que una familia génica de GTPasas rac/rop reguladoras de la actividad de la enzima [10] . Ello sugiere que diferentes miembros de esta familia de oxidasas puedan mediar la producción de ROS en diferentes situaciones, no sólo ante la acción de patógenos sino también en otras respuestas al entorno, así como en procesos del desarrollo. También peroxidasas de la pared celular pueden contribuir a la producción apoplástica de ROS en algunas interacciones planta-patógeno [11] . Estudios detallados con inhibidores indican que ambos mecanismos enzimáticos pueden producir ROS en diferentes contextos espacio/temporales [12] , lo cual sugiere una diferencia funcional entre las diferentes localizaciones de ROS producidas fuera de la célula vegetal.
Aunque la producción de ROS ocurre principalmente en el apoplasto, existen otros compartimentos celulares donde se acumulan ROS que pueden influir en la respuesta planta-patógeno. Niveles elevados de ROS se producen como resultado de anomalías en la transferencia de energía en la cadena respiratoria de la mitocondria, pero sobretodo asociadas a fotosíntesis y fotorespiración en los cloroplastos y peroxisomas de la célula vegetal [2, 13] . Aparte de O2 - y H2 O2 , otras formas sumamente reactivas se producen en estos compartimentos, como el radical hidroxilo (OH - ) y el oxígeno singlete ( 1 O2 ), que pueden influir sobremanera en la homeostasis celular. La importancia de estas fuentes de ROS viene indicada por la necesidad de luz para que la progresión de la muerte celular en la respuesta a patógenos avirulentos [14] .
Existen además diferentes sistemas de detoxificación de ROS incluyendo ascorbato peroxidasas, glutación, superóxido dismutasas y catalasas que mantienen la homeostasis de ROS en diferentes compartimentos de la célula vegetal [4] . Estos enzimas además de contribuir a restringir el daño de las ROS ayudan a precisar el lugar de acción de las cascadas de señales de transducción derivadas de los ROS. La regulación diferencial de estos sistemas, mediada en parte por la hormona vegetal ácido salicílico (SA), contribuye a incrementar el nivel de ROS y la activación de las defensas en respuesta a la infección [15, 16] . Así pues, los diferentes sistemas de producción y detoxificación de ROS en los distintos compartimentos de la célula vegetal hacen posible controlar los niveles locales de ROS, contribuyendo a sus propiedades como señales reguladoras para activar las defensas de forma precisa y controlada.
La correlación entre la acumulación ROS y el establecimiento de las defensas, sugiere que estas ROS podrían tener una función tóxica directa sobre los patógenos , o sobre las células en contacto directo con ellos. Sin embargo, las evidencias indican que las ROS actúan como señales orquestando el establecimiento de la reacción de defensa a nivel de la expresión génica o el fortalecimiento de la pared celular vía entrecruzamiento de proteínas de la pared [3, 6, 17] . Se ha postulado además que las ROS participan en la inducción de muerte celular programada en el sitio de infección que recibe el nombre de respuesta hipersensible (HR, del inglés hypersensitive response), que contribuiría a limitar la diseminación de los agentes infectivos [18] . Sin embargo, gran parte de estos estudios se han realizado en cultivos de células vegetales en combinación con el uso de inhibidores químicos que han de ser verificados mediante aproximaciones genéticas.
El análisis de líneas mutantes de Arabidopsis thaliana o antisentido de Nicotiana benthamiana , en los genes Rboh de la NADPH oxidasa muestra que este enzima es el responsable de la producción de ROS en respuesta a varios hongos y bacterias patógenos [7, 8] . Sin embargo, la ausencia de ROS tiene diferentes efectos en el crecimiento de patógenos y la HR. Mientras que las líneas antisentido de Nicotiana muestran reducción en la HR y mayor crecimiento de hongos patógenos [8] , los mutantes de Arabidopsis muestran también reducida HR en respuesta a bacteria avirulenta pero no diferencias en el crecimiento de la bacteria [7] . Por otro lado estos mismos mutantes de Arabidopsis poseen mayor muerte celular asociada con un menor crecimiento de una cepa del oomiceto Hyaloperonospora parasitica . Así pues las ROS generadas por el mismo enzima pueden tener funciones opuestas en diferentes interacciones planta-patógeno siendo en algunos casos reguladores positivos de la reacción de defensa y muerte celular, mientras que en otros casos actúan como reguladores negativos. Así mismo, el hecho de que dobles mutantes en los genes Rboh muestren un fenotipo acentuado en comparación a los mutantes individuales [7] demuestra la existencia de cierto solapamiento funcional dentro de la familia de las Rboh-NADPH oxidasas.
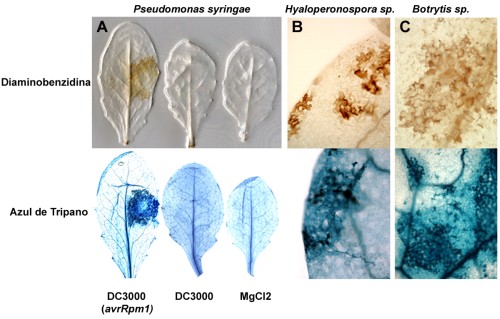 |
Figura 2: Producción de ROS y muerte celular en respuesta a diferentes patógenos. |
Se ha propuesto que las ROS, en combinación con el ácido salicílico, puedan ser las moléculas mediadoras del establecimiento de defensas sistémicas o SAR (del inglés systemic acquired resistance) que actúan a distancia del lugar de interacción del patógeno [19] . La rápida producción de ROS y la capacidad de difusión del H2O2 a través de membranas ha hecho pensar que esta molécula pudiera actuar como segundo mensajero intra o intercelular [3, 6] . Asimismo las ROS podrían afectar la función de NPR1, un mediador clave de las respuestas sistémicas, modificando el estado de oxido-reducción de esta proteína [20] . Sin embargo, aunque el H2O2 puede mediar la acumulación de marcadores de defensa lejos del sitio inicial de infección, estudios con inhibidores muestran que es poco probable que el H2O2 sea la señal que se transloca [21, 22] .
Aunque la acumulación de ROS se correlaciona normalmente con el establecimiento de las respuestas de resistencia a la enfermedad, algunos organismos patógenos pueden salir beneficiados de la acumulación de ROS e incluso se postula que inducirían su producción con este propósito. Es, por ejemplo, el caso de algunos necrótrofos que estimularían la acumulación de ROS modificando los sistemas antioxidantes de los peroxisomas para inducir mayor muerte celular que favorecería la diseminación de la infección [23, 24] . En consecuencia, las ROS son producidas como mediadores de la respuesta de defensa, teniendo en algunos casos propiedades totalmente opuestas según los diferentes sistemas planta-patógeno.
SA y el óxido nítrico (NO, del inglés nitric oxide ) son otros importantes reguladores de la respuesta contra organismos patógenos. La interacción con estas u otras señales puede explicar las funciones divergentes de las ROS en las respuestas de defensa. El Ácido Salicílico (SA) esta involucrado en las respuestas de defensa al ataque de patógenos, local y sistémica [19] . Se ha documentado el sinergismo entre ROS y SA en la regulación de la HR y en el establecimiento de las defensas sistémicas [25] Las ROS estimulan la síntesis de SA [26] y SA a su vez contribuiría a aumentar los niveles de ROS al inhibir diversos sistemas de detoxificación de ROS [16]. Sin embargo, ambas señales tienen efectos opuestos en la regulación de la expansión de la muerte celular en los márgenes de la HR inducida por el patógeno [10]. Mientras que el SA es un regulador positivo, las ROS producidas por la NADPH oxidasa son reguladores negativos de esta muerte celular alrededor de la HR. Esto es muestra de las diferentes funciones de las ROS en diversos contextos espaciales y temporales en relación con otras señales reguladoras. De manera similar, SA y la hormona ácido jasmónico muestran una relación sinérgica o antagónica dependiendo de sus concentraciones, el sinergismo llevando a la acumulación de ROS [27].
NO es otro derivado de oxígeno producido en respuesta al ataque de patógenos [28, 29] . Estudios citológicos muestran que ROS y NO son producidas en el margen de las lesiones [30] . Ambas señales regulan la acumulación de la otra y actúan conjuntamente en la regulación de la muerte celular en respuesta a patógenos [31]. Resulta significativo que también ROS y NO colaboran en el cierre de estomas inducido por la hormona vegetal ácido abscísico [32] , sugiriendo que la interacción entre estas dos señales modula varias respuestas fisiológicas.
Estudios con inhibidores en cultivos de células vegetales en los años 90 pusieron las bases de la importancia de procesos de fosforilación así como el requerimiento de la activación de canales de Ca 2+ para activar la producción de ROS [33, 34] . Aproximaciones genéticas más recientes han confirmado el papel de la fosforilación en la regulación de la producción de ROS [8, 35] . Por su parte Ca 2+ es capaz de activar directamente la Rboh-NADPH oxidasa in vitro [36] . Esta proteína posee 2 dominios de unión de Ca 2+ , denominados manos de Ca 2+ , en la región N-terminal [10] . Por otro lado, las ROS son necesarias para inducir la entrada de Ca 2+ en la célula vegetal tras la inducción con patógenos [37] . En consecuencia, el flujo de Ca 2+ parece actuar tanto aguas arriba como aguas abajo de la acumulación de ROS en la cascada de señales en respuesta a patógenos.
Esta compleja interrelación entre ROS y Ca 2+ ocurre también en otros procesos fisiológicos. Por ejemplo, en el cierre de estomas, ROS funciona como un intermediario del ácido abscísico mediante la activación de canales de Ca 2+ en las células de la guarda [38] . Cabe señalar que las mismas proteínas Rboh responsables de la producción de ROS en respuesta a patógenos median la activación de los canales de Ca 2+ en los estomas [39] , indicando que las mismas NADPH oxidasas regulan diferentes funciones dependientes de ROS en distintos contextos fisiológicos. Así pues, las ROS producidas ante el ataque de patógenos y otros factores ambientales o del desarrollo forman parte de una compleja red de señales que median la respuesta a patógenos así como otras respuestas al entorno.
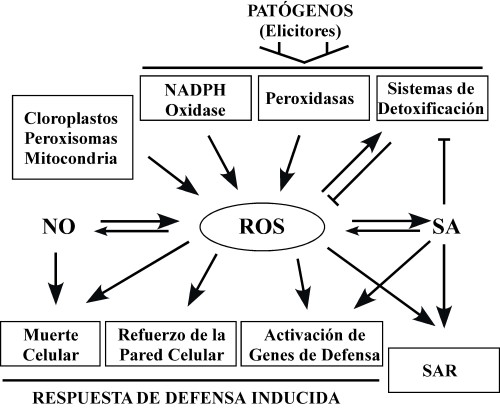 |
| Figura 3. Producción de ROS y funciones en la respuesta a patógenos. |
La rápida producción de ROS en el apoplasto en respuesta al ataque de patógenos coordina el establecimiento de diferentes barreras defensivas contra los patógenos. La NAPDH oxidasa se perfila como el principal mecanismo de producción y fuente de la especificidad de acción de las ROS en diversas respuestas fisiológicas, aunque también contribuyen alteraciones en el balance de diferentes mecanismos de producción y detoxificación de ROS en otros compartimentos de la célula. Diversos estudios muestran que las ROS desempeñan muy diferentes funciones, a veces opuestas, formando parte de complejos sistemas de transducción de señales que median diversas respuestas al entorno o que regulan procesos del desarrollo. Sin embargo quedan aún muchas preguntas sin respuesta en el camino para entender el papel de las ROS en los múltiples procesos fisiológicos en que están involucradas. La función definida de las ROS producidas por diferentes sistemas y el flujo de información entre los diferentes compartimentos donde se acumulan, la interacción con otras señales o los mecanismos de acción de las ROS son algunos retos estimulantes en el camino para conocer el papel de las ROS en la respuesta contra patógenos y en otras muchas funciones mediadas por estas señales en las plantas.